7.7: Espectroscopia de dicroísmo circular y su aplicación para la determinación de la estructura secundaria de especies ópticamente activas
- Page ID
- 70913
La espectroscopia de dicroísmo circular (CD) es uno de los pocos métodos de evaluación de estructuras que se pueden utilizar como alternativa y amplificación a muchas técnicas de análisis convencionales con avances como la recolección rápida de datos y facilidad de uso. Dado que la mayor parte de los esfuerzos y el tiempo dedicado al avance de las ciencias químicas se dedican a la elucidación y análisis de la estructura y composición de moléculas sintetizadas o productos naturales aislados más que a su preparación, se debe conocer todas las técnicas relevantes disponibles y saber cuáles instrumento puede ser empleado como una alternativa a cualquier otra técnica.
El objetivo de este módulo es introducir la técnica de CD y discutir qué tipo de información se puede recopilar mediante CD. Adicionalmente, se mostrarán las ventajas de la CD respecto a otras técnicas de análisis y sus limitaciones.
Actividad óptica
Como la espectroscopia CD solo puede analizar especies ópticamente activas, es conveniente iniciar el módulo con una breve introducción de la actividad óptica. En la naturaleza se entregan casi todas las formas de vida, es decir, que hay cierto grado de asimetría, al igual que en nuestras manos. Uno no puede superponer la mano derecha a la izquierda porque son imágenes especulares no idénticas entre sí. Así son las moléculas quirales (manos), existen como enantiómeros, que reflejan imágenes entre sí (Figura\(\PageIndex{1}\)). Un fenómeno interesante relacionado con las moléculas quirales es su capacidad para rotar el plano de la luz polarizada. La propiedad de actividad óptica se utiliza para determinar la rotación específica, [α] T λ, del enantiómero puro. Esta característica se utiliza en la polarimetría para encontrar el exceso enantiomérico, (ee), presente en la muestra.
Dicroísmo circular
La espectroscopia de dicroísmo circular (CD) es una técnica poderosa pero sencilla para examinar diferentes aspectos de moléculas orgánicas e inorgánicas ópticamente activas. El dicroísmo circular tiene aplicaciones en diversos campos de investigación modernos que van desde la bioquímica hasta la química inorgánica. Tal uso generalizado de la técnica surge de su propiedad esencial de proporcionar información estructural que no puede ser adquirida por otros medios. Otra característica loable del CD es que es una técnica rápida y fácil que hace que el análisis sea cuestión de minutos. Sin embargo, al igual que todos los métodos, la CD tiene una serie de limitaciones, las cuales se discutirán al comparar la CD con otras técnicas de análisis.
La espectroscopia CD y las técnicas relacionadas fueron consideradas como técnicas de análisis esotérico necesarias y accesibles solo para un pequeño grupo clandestino de profesionales. Para que el lector esté más familiarizado con la técnica, en primer lugar, se mostrará el principio de funcionamiento del CD y sus diversos tipos, así como las técnicas relacionadas. Posteriormente se cubrirá la preparación de muestras y el uso de instrumentos para el caso de estudio de estructura secundaria de proteínas.
Dependiendo de la fuente de luz utilizada para la generación de luz polarizada circularmente, existen:
- CD UV lejano, utilizado para estudiar proteínas de estructura secundaria.
- CD cerca de UV, utilizado para investigar la estructura terciaria de las proteínas.
- CD visible, utilizada para monitorear interacciones de proteínas de iones metálicos.
Principio de funcionamiento
En el espectrómetro CD la muestra se coloca en una cuba y se pasa un haz de luz a través de la muestra. La luz (en el presente contexto todas las ondas electromagnéticas serán referidas como luz) que proviene de la fuente se somete a polarización circular, lo que significa que su plano de polarización se hace rotar ya sea en sentido horario (polarización circular derecha) o en sentido contrario a las agujas del reloj (polarización circular izquierda) con el tiempo mientras propagando, ver Figura\(\PageIndex{2}\).
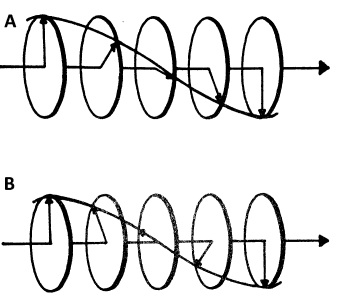
La muestra es, primeramente irradiada con luz polarizada giratoria izquierda, y la absorción se determina por\ ref {1}. Se realiza una segunda irradiación con luz polarizada derecha. Ahora, debido a la asimetría intrínseca de las moléculas quirales, interactuarán con la luz polarizada circularmente de manera diferente según el sentido de rotación va a haber una tendencia a absorber más para una de las direcciones de rotación. La diferencia entre la absorción de luz polarizada circularmente izquierda y derecha son los datos, los cuales se obtienen de\ ref {2}, donde εL y εR son los coeficientes de extinción molar para la luz polarizada circularmente izquierda y derecha, c es la concentración molar, l es la longitud del camino, el ancho de la cubetas (en cm). La diferencia en absorción puede estar relacionada con diferencia en extinción, Δε, por\ ref {3}.
\[ A\ = \varepsilon c l \label{1} \]
\[ \Delta A\ =\ A_{L}-A_{R}\ =\ (\varepsilon _{L}\ -\ \varepsilon _{R} ) c l \label{2} \]
\[ \Delta \varepsilon \ =\ \varepsilon _{L} \ -\ \varepsilon _{R} \label{3} \]
Por lo general, por razones históricas la EC se reporta no solo como diferencia en los coeficientes de absorción o extinción sino como grado de elipticidad, [θ]. La relación entre [θ] y Δε viene dada por\ ref {4}.
\[ [\theta ]\ =\ 3,298 \Delta \varepsilon \label{4} \]
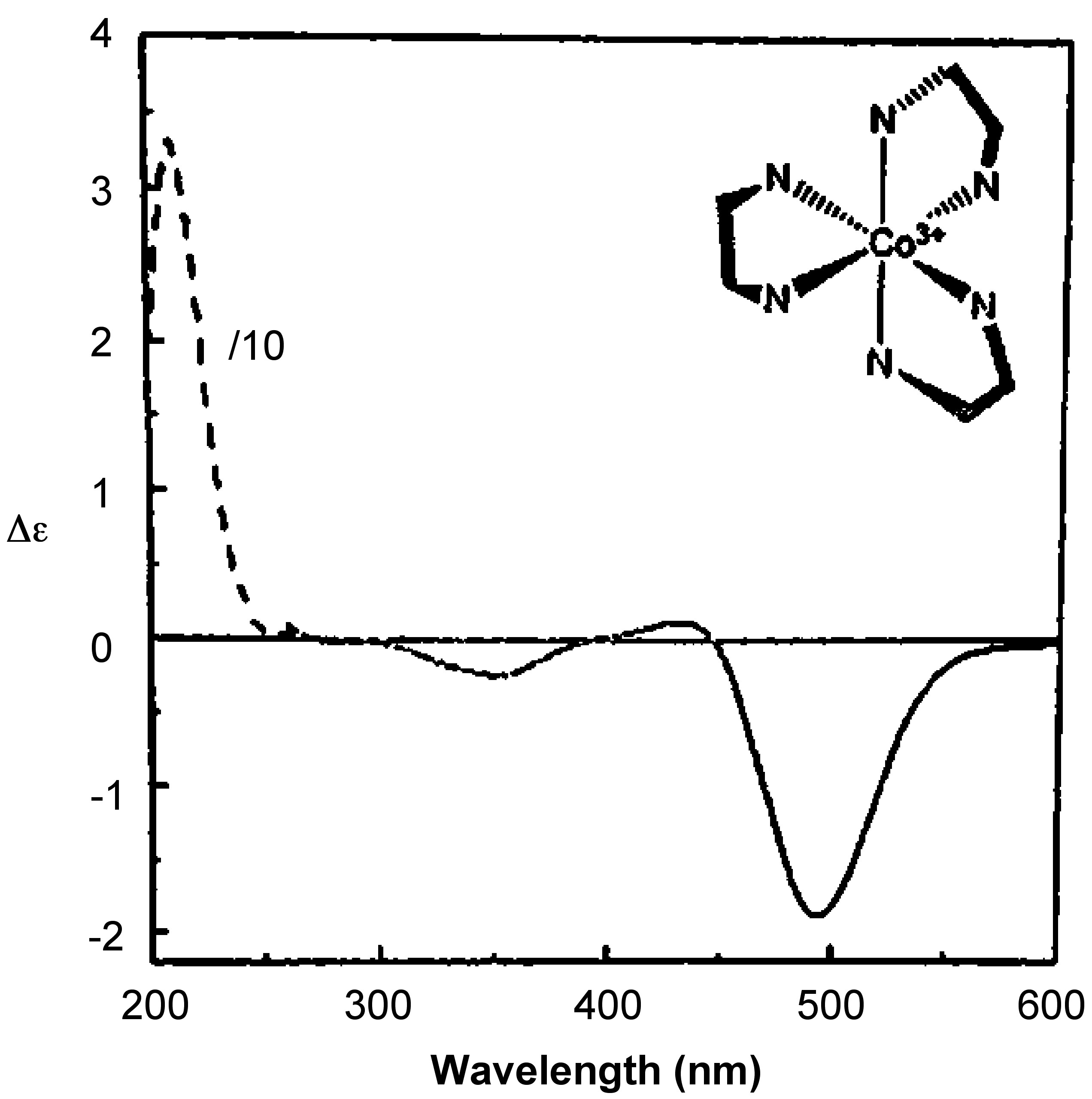
Dado que la absorción se monitorea en un rango de longitudes de onda, la salida es una gráfica de [θ] versus longitud de onda o Δε versus longitud de onda. La figura\(\PageIndex{3}\) muestra el espectro de CD de Δ— [Co (en) 3] Cl 3.
Técnicas Relacionadas
Dicroísmo Circular Magnético
El dicroísmo circular magnético (MCD) es una técnica hermana a la CD, pero hay varias distinciones:
- La MCD no requiere que la muestra posea asimetría intrínseca (es decir, quiralidad/actividad óptica), ya que la actividad óptica se induce aplicando campo magnético paralelo a la luz.
- MCD y CD tienen diferentes reglas de selección, por lo que la información obtenida de estas dos técnicas hermanas es diferente. El CD es bueno para evaluar el ambiente de la parte absorbente de las muestras, mientras que el MCD es superior para obtener información detallada sobre la estructura electrónica de la parte absorbente.
El MCD es un método poderoso para estudiar las propiedades magnéticas de los materiales y recientemente se ha empleado para el análisis del compuesto de hierro-nitrógeno, el imán más fuerte conocido. Además, la MCD y su variación, la temperatura variable MCD son técnicas complementarias a la espectroscopia Mossbauer y la espectroscopia de resonancia paramagnética electrónica (EPR). De ahí que estas técnicas puedan dar una amplificación útil al capítulo sobre la espectroscopia Mossbauer y EPR.
Dicroísmo lineal
El dicrosim lineal (LD) también es una técnica muy relacionada con la CD en la que se mide la diferencia entre la absorbancia de la luz polarizada perpendicular y paralela. En esta técnica el plano de polarización de la luz no gira. El LD se utiliza para determinar la orientación de las partes absorbentes en el espacio.
Ventajas y Limitaciones del CD
Al igual que cualquier otro CD de instrumento tiene sus fortalezas y límites. La comparación entre CD y RMN que se muestra en la Tabla\(\PageIndex{1}\) da un buen sentido de las capacidades de la CD.
| CD | RMN |
|---|---|
| Se pueden estudiar moléculas de cualquier tamaño | Hay limitación de tamaño |
| Los experimentos son rápidos de realizar; las mediciones de longitud de onda única requieren milisegundos | Este no es el caso todo el tiempo. |
| Sensibilidad única a la asimetría en la estructura de la muestra. | Se requieren condiciones especiales para diferenciar entre enantiómeros. |
| Puede trabajar con concentraciones muy pequeñas, alargando el ancho de la cubeta hasta lograr una absorción discernible. | Hay un límite a la sensibilidad del instrumento. |
| La escala de tiempo es mucho más corta (UV), lo que permite estudiar sistemas dinámicos y cinéticas. | La escala de tiempo es larga, el uso de ondas de radio da promedio de todos los sistemas dinámicos. |
| Solo es posible el análisis cualitativo de los datos. | Se pueden realizar análisis cuantitativos de datos para estimar la composición química. |
| No proporciona análisis de estructura de nivel atómico | Muy potente para el análisis de nivel atómico, proporcionando información esencial sobre los enlaces químicos en el sistema. |
| El espectro observado no es suficiente para reclamar una y única estructura posible | El espectro de RMN es información clave para asignar una estructura única. |
¿Qué tipo de datos se obtienen del CD?
Una manera efectiva de demostrar las capacidades de la espectroscopia de CD es cubrir el caso de estudio de estructura secundaria de proteínas, ya que la espectroscopia de CD es una técnica bien establecida para la elucidación de la estructura secundaria de proteínas así como de cualquier otra macromolécula. Mediante el uso de CD se puede estimar el grado de orden conformacional (qué porcentaje de las proteínas de la muestra está en conformación de hélice α y/o lámina β), ver Figura\(\PageIndex{4}\).
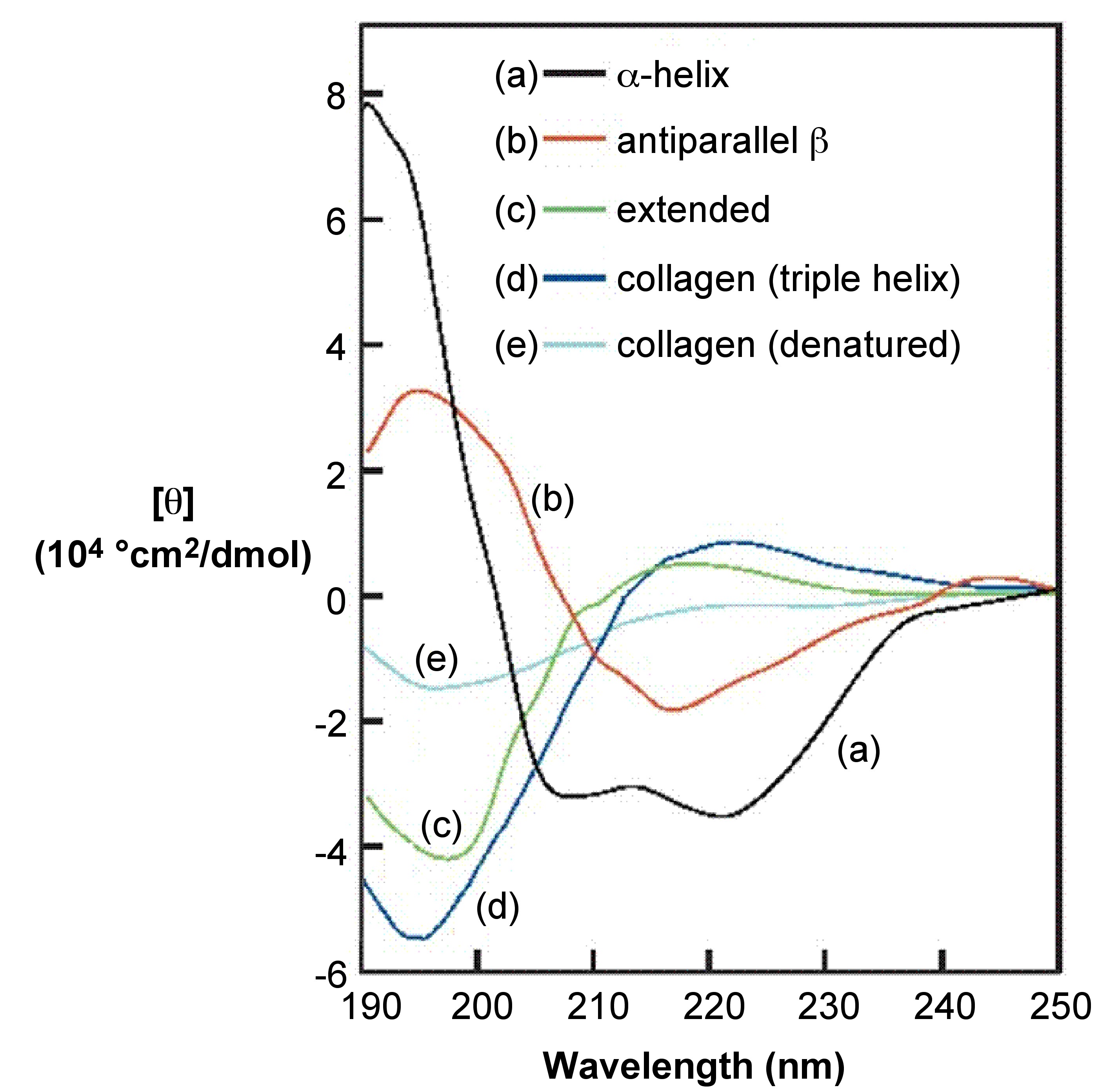
Puntos clave para la estimación visual de la estructura secundaria mediante la observación de un espectro CD:
- Las proteínas α-helicoidales tienen bandas negativas a 222 nm y 208 nm y una banda positiva a 193 nm.
- Las hélices β tienen bandas negativas a 218 nm y bandas positivas a 195 nm.
- Las proteínas que carecen de cualquier estructura secundaria ordenada no tendrán ningún pico por encima de 210 nm.
Dado que los espectros CD de las proteínas representan de manera única su conformación, la CD puede ser utilizada para monitorear cambios estructurales (debido a la formación de complejos, plegado/desplegado, desnaturalización por aumento de temperatura, desnaturalizantes, cambio en la secuencia/mutación de aminoácidos, etc.) en sistemas dinámicos y para estudiar la cinética de proteína. En otras palabras, el CD se puede utilizar para realizar investigaciones de estabilidad y modelado de interacción.
Instrumento de CD
La figura\(\PageIndex{5}\) muestra un instrumento típico de CD.

Protocolo para recopilar un espectro de CD
La mayoría de las proteínas y péptidos requerirán el uso de tampones para evitar la desnaturalización. Se debe tener precaución para evitar el uso de tampones ópticamente activos. Se requieren soluciones claras. El CD se toma en cubetas de cuarzo de alta transparencia para asegurar la menor interferencia. Hay cubetas disponibles que tienen una longitud de trayectoria que va de 0.01 cm a 1 cm. Dependiendo de la actividad UV de los tampones utilizados se debe elegir una cubeta con longitud de trayectoria (distancia que el haz de luz pasa a través de la muestra) que compense la absorbancia UV del tampón. Las soluciones deben prepararse de acuerdo a la cubeta que se utilizará, ver Tabla\(\PageIndex{2}\).
| Trayectoria de Cubeta (cm) | Concentración de la muestra (mg/mL) |
|---|---|
| 0.01-0.02 | 0.2-1.0 |
| 0.1 | 0.05-0.2 |
| 1 | 0.005-0.01 |
Además, al igual que las sales utilizadas para preparar tarimas en FT-IR, los buffers en CD mostrarán cortes en cierto punto en la región de baja longitud de onda, lo que significa que los búferes comienzan a absorber después de ciertas longitudes de onda. Los valores de corte para la mayoría de los búferes comunes son conocidos y se pueden encontrar del fabricante. El oxígeno absorbe la luz por debajo de 200 nm. Por lo tanto, para eliminar interferencias se deben preparar tampones a partir de agua destilada o el agua debe desgasificarse antes de su uso. Otro punto importante es determinar con precisión la concentración de la muestra, ya que la concentración debe conocerse para el análisis de datos de CD. La concentración de la muestra se puede determinar a partir de los coeficientes de extinción, si tales se reportan en la literatura también para muestras de proteínas se puede utilizar el análisis cuantitativo de aminoácidos.
Muchos instrumentos de CD vienen incluidos con una unidad de control de temperatura del compartimento de muestras. Esto es muy útil a la hora de realizar estudios de estabilidad y desplegado/desnaturalización de proteínas. Verifique para asegurarse de que el disipador de calor esté lleno de agua. Encienda la unidad de control de temperatura y ajuste a la temperatura elegida.
La fuente UV en CD es una lámpara muy potente y puede generar grandes cantidades de Ozono en su cámara. El ozono reduce significativamente la vida útil de la lámpara. Por lo tanto, se debe eliminar el oxígeno antes de encender la lámpara principal (de lo contrario se convertirá en ozono cerca de la lámpara). Para ello, el gas nitrógeno se descarga constantemente en el compartimiento de la lámpara. Deje que el Nitrógeno se lave al menos durante 15 min. antes de encender la lámpara.
Recolección de espectros para blanco, agua, fondo de búfer y muestra
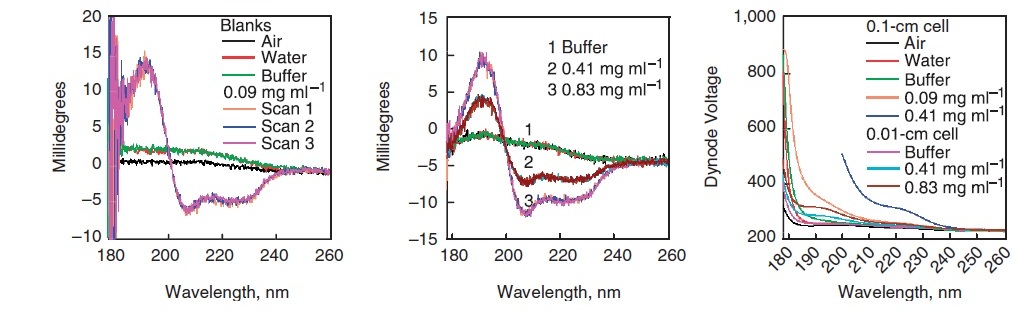
- Recoger espectro de aire en blanco (Figura\(\PageIndex{6}\)). Esto será esencialmente una línea que se encuentra en el eje x del espectro, absorbancia cero.
- Llena la cubeta con agua y toma un espectro.
- Las gotas de agua que quedan en la cubeta pueden cambiar la concentración de su muestra, especialmente cuando se trabaja con muestras diluidas. De ahí que sea importante secar completamente la cubeta. Después de secar la cubeta, recoger espectro de tampón de exactamente la misma concentración que se utilizó para la muestra (Figura\(\PageIndex{6}\)). Esta es la etapa en la que se confirma que el tampón es el espectro adecuado del tampón y el agua debe superponerse dentro del error experimental, excepto para la región de longitud de onda baja donde la relación señal-ruido es baja.
- Limpie la cubeta como se describió anteriormente y llénelo con solución de muestra. Recopile el espectro de CD tres veces para una mejor precisión (Figura\(\PageIndex{6}\)). Para las proteínas, múltiples barridos deben superponerse y no derivar con el tiempo.
Manejo y Análisis de Datos
Después de guardar los datos tanto para los espectros de la muestra como en blanco se suaviza usando comandos incorporados del software del controlador. La línea base alisada se resta del espectro suavizado de la muestra. El siguiente paso es utilizar paquetes de software que tengan algoritmos para estimar la estructura secundaria de las proteínas. Ingrese los datos en el paquete de software de elección y procesarlos. La salida de algoritmos será el porcentaje de una conformación de estructura secundaria particular en la muestra. Los datos mostrados en la Figura\(\PageIndex{7}\) enumeran los métodos de uso común y los compara para varias proteínas. La estructura secundaria estimada se compara con los datos de rayos X, y se puede ver que es mejor usar varios métodos para obtener la mejor precisión.

Conclusión
¿Qué ventajas tiene la CD sobre otros métodos de análisis? La espectroscopia CD es un método excelente y rápido para evaluar la estructura secundaria de las proteínas y realizar estudios de sistemas dinámicos como el plegamiento y la unión de proteínas. Vale la pena señalar que CD no proporciona información sobre la posición de aquellas subunidades con conformación específica. Sin embargo, la EC elimina otras técnicas en la evaluación rápida de la estructura de muestras de proteínas desconocidas y en el monitoreo de cambios estructurales de proteínas conocidas causadas por ligadura y formación de complejos, cambio de temperatura, mutaciones, desnaturalizantes. La CD también se usa ampliamente para yuxtaponer proteínas fusionadas con contrapartes de tipo silvestre, ya que los espectros de CD pueden decir si la proteína fusionada conservó la estructura de tipo silvestre o sufrió cambios.


