8.9: Caracterización de Bionanopartículas mediante Análisis de Movilidad Diferencial por Electrospración
- Page ID
- 71318
|El análisis de movilidad diferencial por electropulverización (ES-DMA) es una técnica analítica que utiliza primero una electropulverización para aerosolizar partículas y luego DMA para caracterizar su movilidad eléctrica en condiciones ambientales. Esta herramienta versatil puede ser utilizada para caracterizar cuantitativamente biomoléculas y nanopartículas de 0.7 a 800 nm. En la década de 1980, se descubrió que la ES podría ser utilizada para producir aerosoles de biomacromoléculas. En el caso del DMA, su predecesor fue desarrollado por Hewitt en 1957 para analizar la carga de pequeñas partículas. El DMA modificado, que es un tipo de analizador de movilidad iónica, fue desarrollado por Knuts} on y Whitby (Figura\(\PageIndex{1}\)\) en 1975 y posteriormente se comercializó. Entre los diversos diseños, el DMA cilíndrico se ha convertido en el diseño estándar y se ha utilizado para la obtención de aerosoles monodispersos, así como para la clasificación de aerosoles polidispersos.

La primera integración de ES con DMA ocurrió en 1996 cuando se utilizó esta técnica para determinar el tamaño de diferentes proteínas globulares. El DMA se refinó durante la última década para ser utilizado en una amplia gama de aplicaciones para la caracterización de polímeros, virus, bacteriófagos y conjugados nanopartícula-biomolécula. Aunque numerosas publicaciones han reportado el uso de ES-DMA en aplicaciones medicinales y farmacéuticas, este módulo describe los principios generales de la técnica y su aplicación en el análisis de nanopartículas de oro.
¿Cómo funciona ES-DMA?
ES-DMA consiste en una fuente de electropulverización (ES) que aerosoliza bionanopartículas y una clase de analizador de movilidad iónica (DMA) que mide su movilidad eléctrica equilibrando las fuerzas eléctricas y de arrastre sobre las partículas. El DMA separa continuamente las partículas en función de su relación carga/tamaño. En la Figura se muestra un esquema de la configuración experimental para ES-DMA\(\PageIndex{2}\) para el análisis de nanopartículas de oro.
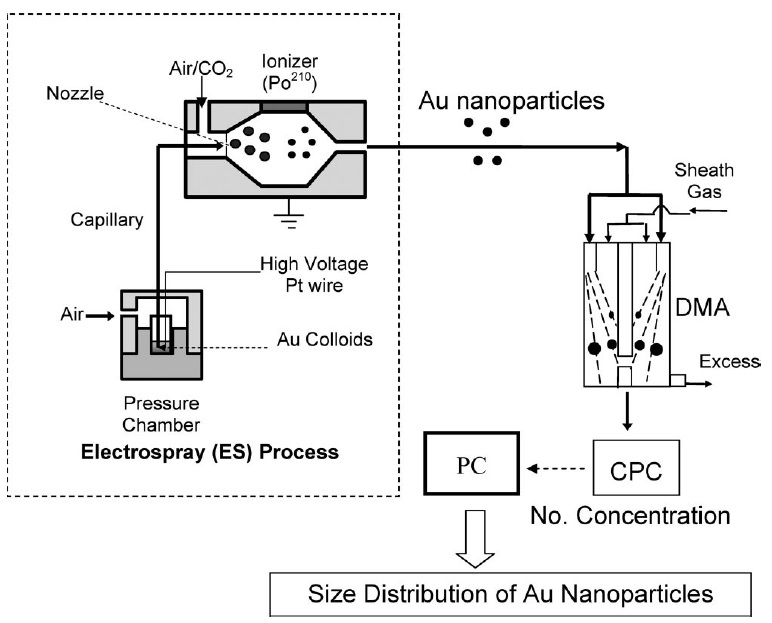
El proceso de análisis de partículas con ES-DMA implica cuatro pasos:
Primero, el analito disuelto en un tampón volátil como el acetato amónico [NH4] [O2CCH3] se coloca dentro de una cámara de presión. Luego, la solución se entrega a la boquilla a través de un capilar de sílice fundida para generar gotitas de carga múltiple. Los nebulizadores ES producen gotitas de 100-400 nm de diámetro pero están muy cargadas.
En el siguiente paso, las gotitas se mezclan con aire y dióxido de carbono (CO2) y se hacen pasar a través del reductor de carga o neutralizador donde el disolvente continúa evaporándose y la distribución de carga disminuye. El reductor de carga es una fuente de radiación ionizante α como Po210 que ioniza el gas portador y reduce las cargas netas en las partículas a una distribución de Fuchs'-Boltzmann. Como resultado, la mayoría de las gotitas contienen partículas de carga neta única que pasan directamente al DMA. El DMA separa las partículas cargadas positiva o negativamente aplicando un potencial negativo o positivo. La figura\(\PageIndex{3}\) muestra un diseño de canal único de DMA cilíndrico que está compuesto por dos electrodos concéntricos entre los cuales se aplica una tensión. El electrodo interno se mantiene a un voltaje controlado de 1V a 10 kV, mientras que el electrodo externo está conectado a tierra eléctricamente.
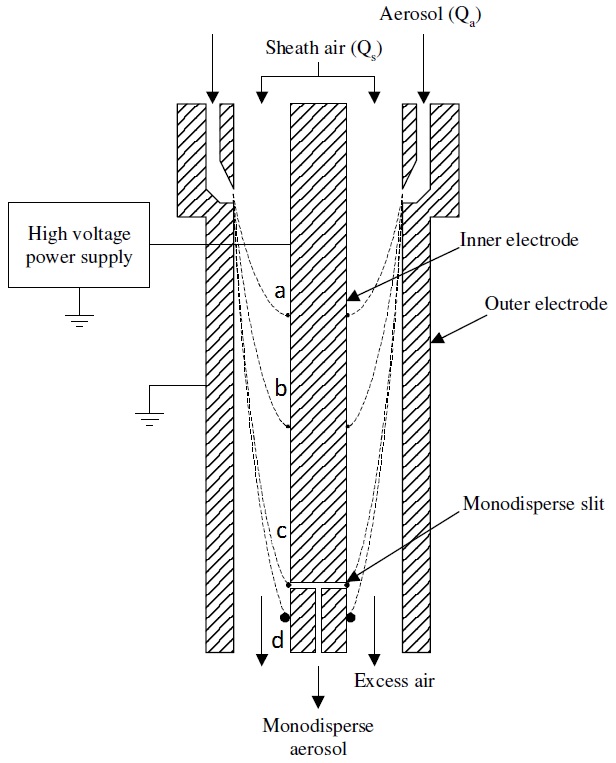
En la tercera etapa, el flujo de aerosol (Qa) entra a través de una hendidura que es adyacente a un electrodo y se introduce el flujo de aire de la vaina (aire o N2) (Qs) para separar el flujo de aerosol del otro electrodo. Después de aplicar un voltaje entre los electrodos interno y externo, se forma un campo eléctrico y las partículas cargadas con movilidad eléctrica específica son atraídas hacia una varilla colectora cargada. Las posiciones de las partículas cargadas a lo largo de la longitud del colector dependen de su movilidad eléctrica (Zp), el caudal de fluido y la geometría DMA. En el caso de partículas con una alta movilidad eléctrica, se recogen en la parte superior de la varilla (partículas a y b, Figura\(\PageIndex{4}\)) mientras que las partículas con una movilidad eléctrica baja se recogen en la parte inferior de la varilla (partícula d, Figura\(\PageIndex{3}\).
\[ Z_{p} = \frac{(Q_{s}\ +\ Q_{a})ln(R_{2})}{R_{1}} \label{1} \]
Con el valor de la movilidad eléctrica, el diámetro de partícula (dp) se puede determinar utilizando la ley de Stokes como se describe en\ ref {2}, donde n es el número de unidades de carga, e es la unidad elemental de carga (1.61x10-19C), Cc es el factor de corrección de deslizamiento de Cunningham y µ es la viscosidad del gas. C c\ ref {3}, considera el efecto de flujo no continuo cuando dp es similar o menor que la trayectoria libre media (λ) del gas portador.
\[ d_{p} \ =\frac{n_{e}C_{c}}{3\pi \mu Z^{p}} \label{2} \]
\[ C_{c} = 1\ +\ \frac{2\lambda }{d_{p}} [1.257\ +\ 0.4e^{-\frac{-1.10 d_{p}}{2\lambda }}] \label{3} \]
En el último paso, las partículas seleccionadas por tamaño se detectan con un contador de partículas de condensación (CPC) o un electrómetro de aerosol (AE) que determina la concentración del número de partículas. El CPC tiene límites de detección y cuantificación más bajos y es el detector más sensible disponible. El AE se utiliza cuando las concentraciones de partículas son altas o cuando las partículas son tan pequeñas que no pueden ser detectadas por CPC. La figura\(\PageIndex{4}\) muestra el funcionamiento del CPC en el que el aerosol se mezcla con butanol (C4H9OH) o vapor de agua (fluido de trabajo) que se condensa sobre las partículas para producir sobresaturación. De ahí que se obtengan partículas de gran tamaño (alrededor de 10 μm), detectadas ópticamente y contadas. Dado que cada gotita es aproximadamente del mismo tamaño, el recuento no está sesgado. La distribución del tamaño de partícula se obtiene cambiando el voltaje aplicado. Generalmente, el desempeño del CPC se evalúa en términos del tamaño mínimo que se cuenta con 50% de eficiencia.

¿Qué tipo de información obtiene ES-DMA?
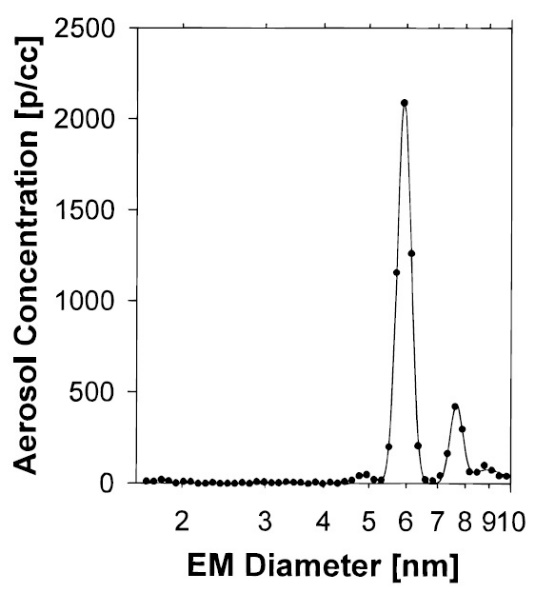
ES-DMA proporciona información del diámetro de movilidad de las partículas y su concentración en número de partículas por unidad de volumen de gas analizado de manera que se obtiene la distribución del tamaño de partícula como se muestra en la Figura\(\PageIndex{10}\). Otra forma de representación de datos es la gráfica de distribución diferencial de ΔN/δlogD p vs d p (Figura\(\PageIndex{11}\). Esta presentación tiene un eje de tamaño logarítmico que suele ser más conveniente porque las partículas suelen distribuirse en una amplia gama de tamaños.
¿Cómo se procesan los Datos de ES-DMA?
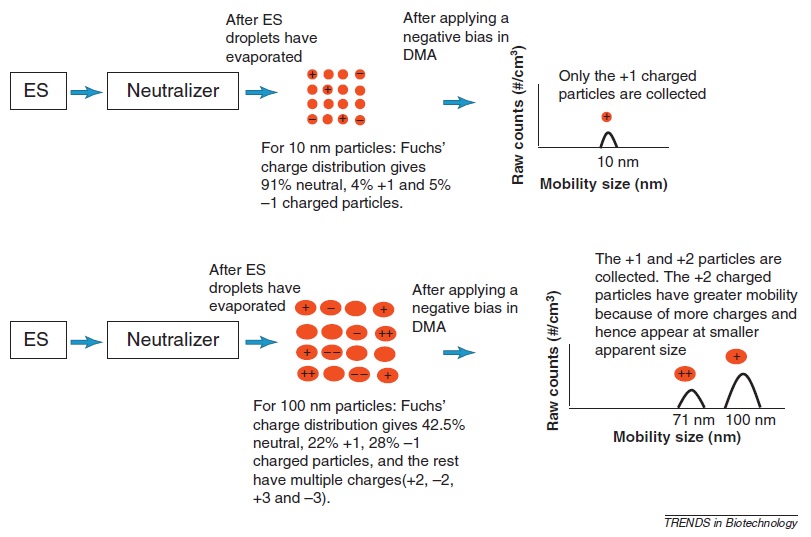
Para obtener la distribución real del tamaño de partícula (Figura), los datos brutos adquiridos con el ES-DMA se corrigen para corrección de carga, función de transferencia del DMA y eficiencia de recolección para CPC. La figura\(\PageIndex{6}\) ilustra la corrección de carga en la que es necesario un reductor de carga o neutralizador para reducir el problema de la carga múltiple y simplificar la distribución de tamaños. La reducción de carga depende del tamaño de partícula y se pueden producir múltiples cargas a medida que aumenta el tamaño de partícula. Por ejemplo, para partículas de 10 nm, los porcentajes de partículas con carga simple son menores que los de partículas neutras. Después de aplicar un voltaje negativo, solo se recogen las partículas cargadas positivamente. Por el contrario, para las partículas de 100 nm, los porcentajes de partículas con carga simple aumentan y están presentes múltiples cargas. De ahí que después de aplicar un sesgo negativo, se recolectan +1 y +2 partículas. La presencia de más cargas en partículas indica alta movilidad eléctrica y
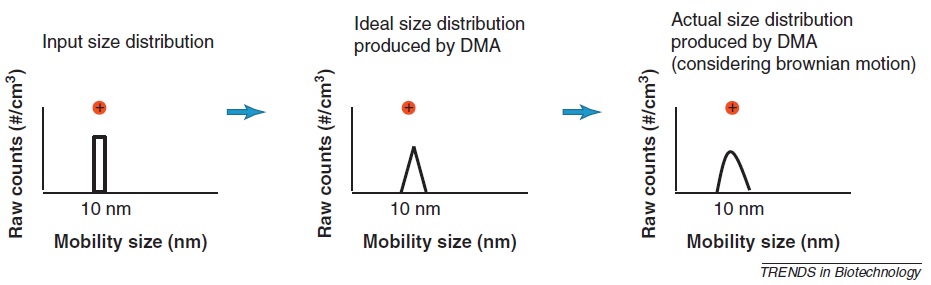
La función de transferencia para DMA modifica la distribución del tamaño de partícula de entrada y afecta la resolución como se muestra en la Figura\(\PageIndex{7}\). Esta función de transferencia depende de las condiciones de operación como los caudales y la geometría del DMA. Además, la función de transferencia puede ampliarse por difusión browniana y este efecto produce la distribución real del tamaño. La resolución teórica se mide por la relación entre la envoltura y el flujo de aerosol en condiciones de flujo en equilibrio (el flujo de la envoltura es igual al flujo excesivo y el flujo de aerosol es igual al flujo de aerosol monodisperso).
El CPC tiene un límite de tamaño de detección de 2.5 nm debido a que las partículas pequeñas son difíciles de activar en la sobresaturación del fluido de trabajo. Por lo tanto, se requiere eficiencia de recolección de CPC que consiste en la calibración del CPC contra un electrómetro.
- Aplicaciones de ES-DMA Determinación del peso molecular de polímeros y proteínas en el rango de 3.5 kDa a 2 MDa correlacionando el peso molecular y el diámetro de movilidad.
- Determinación de la concentración numérica absoluta de nanopartículas en solución mediante la obtención de las distribuciones de tamaño de gotita ES y el análisis estadístico para encontrar la concentración de monómero original. Se pueden formar dímeros o trímeros en el proceso de electronebulización debido a la agregación inducida por gotitas y se observan en el espectro.
- Cinética de agregación de nanopartículas en solución mediante el análisis de distribuciones de movilidad multimodal a partir de las cuales se pueden identificar distintos tipos de estados de agregación.
- Cuantificación de la adsorción de ligandos a bionanopartículas mediante la medición de la reducción en la movilidad eléctrica de una partícula compleja (partícula-proteína) que corresponde a un aumento en el diámetro de movilidad.
Caracterización de nanopartículas de oro funcionalizadas con SAM-mediante ES-DMA
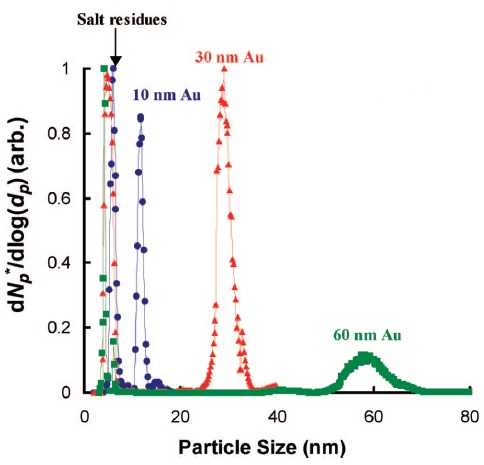
Citrato (Figura nanopartículas de oro\(\PageIndex{8}\) estabilizadas (AuNP)) con diámetro en el rango de 10-60 nm y AuNP conjugadas se analizan mediante ES-DMA. Esta investigación muestra que la formación de partículas de sal en la superficie de las AUNP puede interferir con el análisis de movilidad debido a la reducción en las señales de analito. Dado que el citrato de sodio es una sal soluble no volátil, el ES produce dos tipos de gotitas. Una gotita consiste en AuNPs y sal y la otra gotita contiene solo sal. Por lo tanto, las muestras deben limpiarse por centrifugación antes de determinar el tamaño de las APNP desnudas. La Figura\(\PageIndex{9}\) presenta la distribución de tamaños de AUNP de distintos diámetros y picos correspondientes a residuos de sal.
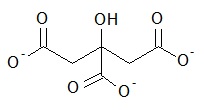
El tamaño de movilidad de las AuNP desnudas (dp0) se puede obtener usando\ ref {4}, donde dp, m y ds son tamaños de movilidad de las AuNP incrustadas con sales y la sal NP, respectivamente. Sin embargo, la presencia de monocapa autoensamblada (SAM) produce una diferencia en la movilidad eléctrica entre AuNP conjugadas y desnudas. Por lo tanto, la determinación del diámetro de las AuNP (libres de sal) es crítica para distinguir el incremento de tamaño después de la funcionalización con SAM. El espesor de recubrimiento de SAM que corresponde al cambio en el tamaño de partícula (ΔL) se calcula usando\ ref {5}, donde dp y dp0 son los diámetros de movilidad de partículas recubiertas y no recubiertas, respectivamente.
\[ d_{p0} =\ \sqrt[3]{d_{p,m}^{3}\ -\ d^{3}_{s}} \label{4} \]
\[ \Delta L\ =\ d_{p}\ -\ d_{p0} \label{5} \]
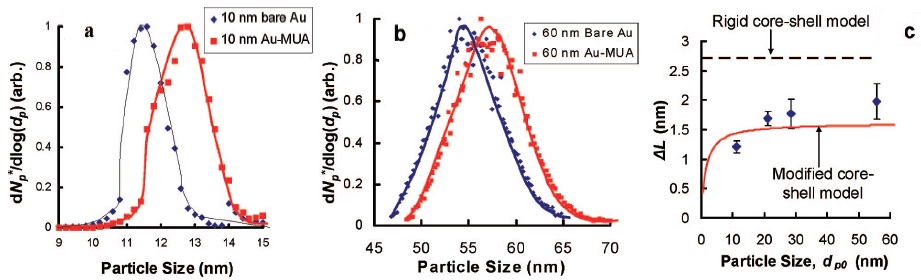
Además, el cambio en el tamaño de partícula se puede determinar considerando un modelo simple de núcleo-cubierta rígido que da valores teóricos de ΔL1 superiores a los experimentales (ΔL). Se propone un modelo de núcleo-cubierta modificado en el que se observa un efecto dependiente del tamaño en ΔL2 para un rango de tamaños de partícula. Las AUP de 10 nm y 60 nm se recubren con MUA (Figura\(\PageIndex{10}\)), un alcanotiol de carga, y las distribuciones de tamaño de partícula de las AUNP desnudas y recubiertas se presentan en la Figura. El incremento en el tamaño promedio de partícula es de 1.2 ± 0.1 nm para las AuNP de 10 nm y 2.0 ± 0.3 nm para las AuNP de 60 nm de manera que ΔL depende del tamaño de partícula.

Ventajas de ES-DMA
- ES-DMA no necesita información previa sobre el tipo de partícula.
- Caracteriza un amplio rango de tamaño de partícula y opera bajo condiciones de presión ambiente.
- Se requieren unos pocos µL o menos de volumen de muestra y el tiempo total de análisis es de 2-4 min.
- Interpretación de datos y espectros de movilidad simples de analizar en comparación con ES-MS donde hay varios estados de carga.
Limitaciones de ES-DMA
- El análisis requiere las siguientes condiciones de solución: concentraciones de unos pocos cientos µg/mL, baja fuerza iónica (<100 mM) y tampones volátiles.
- La incertidumbre suele ser de ± 0.3 nm de un rango de tamaño de unos pocos nm a alrededor de 100 nm. Esto no es apropiado para distinguir proteínas con ligeras diferencias en el peso molecular.
Técnicas Relacionadas
Una técnica en tándem es ES-DMA-APM que determina la masa de ligandos adsorbidos a nanopartículas después de la selección de tamaño con DMA. APM es un analizador de masa de partículas en aerosol que mide la masa de partículas equilibrando las fuerzas eléctricas y centrífugas. DMA-APM se ha utilizado para analizar la densidad de nanotubos de carbono, la porosidad de las nanopartículas y las diferencias de masa y densidad de nanopartículas metálicas que sufren oxidación.
r

