9.4: Caracterización de Catalizadores Usando Detector de Conductividad
- Page ID
- 70911
Introducción
Un catalizador es una “sustancia que acelera la velocidad de las reacciones químicas sin ser consumida”. Algunas reacciones, como la hidrodecloración de TCE,\ ref {1}, no ocurren espontáneamente, sino que pueden ocurrir en presencia de un catalizador.
\[ C_{2}Cl_{3}H\ +\ 4H_{2} \underset{PD}\rightarrow C_{2}H_{6}\ +\ 3HCl \label{1} \]
La dispersión de metales es un término común dentro de la industria de catalizadores. El término se refiere a la cantidad de metal que es activo para una reacción específica. Supongamos que un material catalizador tiene una composición de 1% en peso de paladio y 99% de alúmina (Al2O3\(\PageIndex{1}\)) (Figura) Aunque el material catalizador tiene 1% en peso de paladio, no todo el paladio está activo. El material podría estar oxidado debido a la exposición al aire o parte del material no está expuesto a la superficie (Figura\(\PageIndex{2}\)), de ahí que no pueda participar en la reacción. Por esta razón es importante caracterizar el material.

Para que el Pd reaccione de acuerdo con\ ref {1}, necesita estar en forma metálica. Cualquier paladio oxidado estará inactivo. Por lo tanto, es importante determinar el estado de oxidación de los átomos de Pd en la superficie del material. Esto se puede lograr usando un experimento llamado reducción programada de temperatura (TPR). Posteriormente, el porcentaje de paladio activo se puede determinar por quimisorción de hidrógeno. El porcentaje de metal activo es un parámetro importante al comparar el rendimiento de múltiples catalizadores. Por lo general, la velocidad de reacción se normaliza por la cantidad de catalizador activo.
Principio de Conductividad Térmica
La conductividad térmica es la capacidad de una especie química para conducir calor. Cada gas tiene una conductividad térmica diferente. Las unidades de conductividad térmica en el sistema internacional de unidades son W/m·K.\(\PageIndex{1}\) La tabla muestra la conductividad térmica de algunos gases comunes.
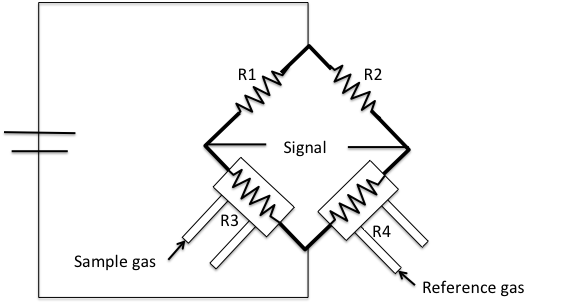
Este detector es parte de un instrumento comercial típico como un Micromeritics AutoChem 2920 (Figura\(\PageIndex{4}\)). Este instrumento es un analizador automatizado con la capacidad de realizar reacciones de adsorción química y temperatura programada en un catalizador, soporte de catalizador u otros materiales.
Reducción programada de temperatura (TPR)
El TPR determinará el número de especies reducibles en un catalizador y dirá a qué temperatura se redujo cada una de estas especies. Por ejemplo, el paladio se encuentra normalmente como Pd (0) o Pd (II), es decir, estados de oxidación 0 y +2. Pd (II) se puede reducir a temperaturas muy bajas (5 - 10 °C) a Pd (0) siguiendo\ ref {2}.
\[ PdO\ +\ H_{2} \rightarrow Pd(0)\ +\ H_{2}O \label{2} \]
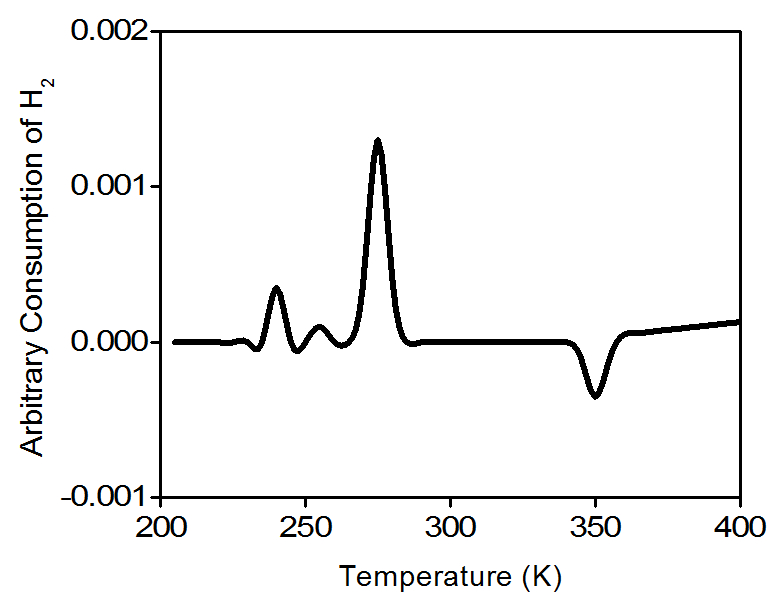
Para el experimento se utilizó una muestra de 128.9 mg 1% en peso de Pd/Al 2 O 3, Figura\(\PageIndex{5}\). Dado que queremos estudiar el estado de oxidación del catalizador comercial, no es necesario realizar un pretratamiento a la muestra. Como gas de análisis y referencia se emplea una mezcla de hidrógeno al 10% y argón. El argón tiene una conductividad térmica baja y el hidrógeno tiene una conductividad térmica mucho mayor. Todos los gases fluirán a 50 cm 3 /min El experimento de TPR comenzará a una temperatura inicial de 200 K, rampa de temperatura de 10 K/min y temperatura final de 400 K. La mezcla de H 2 /Ar se hace fluir a través de la muestra, y más allá del detector en el puerto de análisis. Mientras que en el puerto de referencia la mezcla no entra en contacto con la muestra. Cuando el gas de análisis comienza a fluir sobre la muestra, el detector establece una lectura de línea base. La línea base se establece a la temperatura inicial para asegurar que no haya reducción. Mientras este gas fluye, la temperatura de la muestra se incrementa linealmente con el tiempo y se registra el consumo de hidrógeno. Los átomos de hidrógeno reaccionan con los átomos de oxígeno para formar H 2 O.
Las moléculas de agua se eliminan de la corriente de gas usando una trampa fría. Como resultado, la cantidad de hidrógeno en la mezcla de gas argón/hidrógeno disminuye y la conductividad térmica de la mezcla también disminuye. El cambio se compara con el gas de referencia y rendimientos con un volumen de captación de hidrógeno. La figura\(\PageIndex{6}\) es un perfil típico de TPR para PDo.
Quimisorción de Pulso
Una vez que el catalizador (1% en peso de Pd/Al2O3) se haya reducido completamente, el usuario podrá determinar cuánto paladio está activo. Un experimento de quimisorción por pulsos determinará el área de superficie activa, el porcentaje de dispersión de metal y el tamaño de partícula. Se introducirán pulsos de hidrógeno en el tubo de muestra para interactuar con la muestra. En cada pulso el hidrógeno sufrirá una adsorción disociativa sobre los sitios activos de paladio hasta que todos los átomos de paladio hayan reaccionado. Después de que todos los sitios activos hayan reaccionado, los pulsos de hidrógeno emergen sin cambios del tubo de muestra. La cantidad de hidrógeno quimisorbido se calcula como la cantidad total de hidrógeno inyectado menos la cantidad total eluida del sistema.
Recopilación de datos para quimisorción por pulsos de hidrógeno
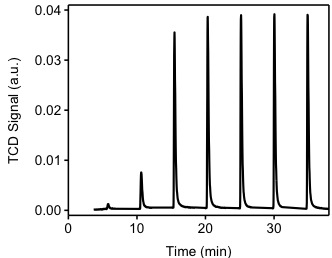
Para este experimento se utilizará la muestra del experimento previo (TPR). Se utilizará argón de ultra alta pureza para purgar la muestra a un caudal de 40 cm 3 /min. La muestra se calentará a 200 °C con el fin de eliminar todos los átomos de hidrógeno quimisorbidos de la superficie de Pd (0). La muestra se enfría a 40 °C. El argón se utilizará como gas portador a un flujo de 40 cm 3 /min. La temperatura de los filamentos será de 175 °C y la temperatura del detector será de 110 °C. El bucle de inyección tiene un volumen de 0.03610 cm 3 @ STP. Como se muestra en la Figura\(\PageIndex{6}\), se inyectarán pulsos de hidrógeno en la corriente de flujo, transportados por argón para entrar en contacto y reaccionar con la muestra. Cabe señalar que el primer pulso de hidrógeno fue casi completamente adsorbido por la muestra. El segundo y tercer pulsos muestran cómo se han saturado las muestras. El valor positivo del detector de TCD es consistente con nuestros supuestos. Dado que el hidrógeno tiene una conductividad térmica más alta que el argón, al fluir a través del detector tenderá a enfriar los filamentos, el detector aplicará entonces un voltaje positivo a los filamentos para mantener una temperatura constante.
Análisis de datos de quimisorción de pulsos
\(\PageIndex{1}\)La tabla me muestra la integración de los picos de la Figura\(\PageIndex{7}\). Esta integración se realiza mediante un software automatizado proporcionado con el instrumento. Cabe señalar que el primer pulso fue consumido completamente por la muestra, el pulso se inyectó entre los tiempos 0 y 5 minutos. De la Figura\(\PageIndex{7}\) observamos que durante los primeros cuatro pulsos, el hidrógeno es consumido por la muestra. Después del cuarto pulso, parece que la muestra no está consumiendo hidrógeno. El experimento continúa por un total de siete pulsos, en este punto el software determina que no se está produciendo ningún consumo y detiene el experimento. El pulso ocho se denomina “pico de saturación”, es decir, el pulso en el que no se consumió hidrógeno.
| Pulso n | Área |
| 1 | 0 |
| 2 | 0.000471772 |
| 3 | 0.00247767 |
| 4 | 0.009846683 |
| 5 | 0.010348201 |
| 6 | 0.10030243 |
| 7 | 0.009967717 |
| 8 | 0.010580979 |
Usando\ ref {3} se calcula el cambio de área (Δarea n) para cada área de pulso pico (área n) y se compara con la del área de pulso de saturación (saturación de área = 0.010580979). Cada uno de estos cambios en el área es proporcional a una cantidad de hidrógeno consumida por la muestra en cada pulso. En la tabla se\(\PageIndex{2}\) muestra el cambio calculado en el área.
\[ \Delta Area_{n}\ =\ Area_{saturation}\ -\ Area_{n} \label{3} \]
| Pulso n | Área n | δÁrea n |
| 1 | 0 | 0.010580979 |
| 2 | 0.000471772 | 0.0105338018 |
| 3 | 0.00247767 | 0.008103309 |
| 4 | 0.009846683 | 0.000734296 |
| 5 | 0.010348201 | 0.000232778 |
| 6 | 0.010030243 | 0.000550736 |
| 7 | 0.009967717 | 0.000613262 |
| 8 | 0.010580979 | 0 |
Los valores Δarea n se convierten luego en consumo de gas hidrógeno usando\ ref {4}, donde F c es el factor de conversión área a volumen para hidrógeno y SW es el peso de la muestra. F c es igual a 2.6465 cm 3 /área de pico. En la tabla se\(\PageIndex{3}\) muestran los resultados del volumen adsorbido y el volumen acumulado adsorbido. Usando los datos de Table\(\PageIndex{3}\), ahora se pueden realizar una serie de cálculos con el fin de tener una mejor comprensión de nuestras propiedades catalíticas.
\[ V_{adsorbed}\ =\ \frac{\Delta Area_{n} \times F_{c}}{SW} \label{4} \]
| Pulso n | zona n | Δárea n | V adsorbido (cm 3 /g STP) | Cantidad acumulada (cm 3 /g STP) |
| 1 | 0 | 0.0105809790 | 0.2800256 | 0.2800256 |
| 2 | 0.000471772 | 0.0105338018 | 0.2787771 | 0.558027 |
| 3 | 0.00247767 | 0.0081033090 | 0.2144541 | 0.7732567 |
| 4 | 0.009846683 | 0.0007342960 | 0.0194331 | 0.7926899 |
| 5 | 0.010348201 | 0.0002327780 | 0.0061605 | 0.7988504 |
| 6 | 0.010030243 | 0.0005507360 | 0.0145752 | 0.8134256 |
| 7 | 0.009967717 | 0.000613262 | 0.0162300 | 0.8296556 |
| 8 | 0.010580979 | 0 | 0.0000000 | 0.8296556 |
Gramo Peso molecular
El peso molecular gramo es el promedio ponderado del número de moles de cada metal activo en el catalizador. Dado que se trata de un catalizador monometálico, el peso molecular gramo es igual al peso molecular del paladio (106.42 [g/mol]). El GMC Calc se calcula usando\ ref {5}, donde F es la fracción del peso de la muestra para el metal N y W atomicN es el peso molecular gramo del metal N (g/g-mol). \ ref {6} muestra el cálculo para este experimento.
\[ GMW_{Calc}\ =\ \frac{1}{(\frac{F_{1}}{W_{atomic\ 1}})\ +\ (\frac{F_{2}}{W_{atomic\ 2}})\ +\ ...\ +\ (\frac{F_{N}}{W_{atomic\ N}})} \label{5} \]
\[ GMW_{Calc}\ =\ \frac{1}{(\frac{F_{1}}{W_{atomic\ Pd}})}\ =\ \frac{W_{atomic\ PD}}{F_{1}}\ =\ \frac{106.42 \frac{g}{g-mole}}{1}\ =\ 106.42 \frac{g}{g-mole} \label{6} \]
Dispersión de metal
La dispersión metálica se calcula usando\ ref {7}, donde PD es el porcentaje de dispersión metálica, Vs es el volumen adsorbido (cm 3 en STP), SFCalc es el factor estequiométrico calculado (igual a 2 para un sistema de paladio-hidrógeno), SW es el peso de la muestra y GMWCalc es el peso molecular gramo calculado de la muestra [g/g-mol]. Por lo tanto, en\ ref {8} obtenemos una dispersión metálica de 6.03%.
\[ PD\ =\ 100\ \times \ (\frac{V_{s} \times SF_{Calc}}{SW \times 22414}) \times GMW_{Calc} \label{7} \]
\[ PD\ =\ 100\ \times \ (\frac{0.8296556 [cm^{3}]\ \times \ 2}{0.1289 [g]\ \times 22414 [\frac{cm^{3}}{mol}]})\ \times \ 106.42 [\frac{g}{g-mol}]\ =\ 6.03\% \label{8} \]
Superficie Metálica por Gramo de Metal
El área de superficie metálica por gramo de metal se calcula usando\ ref {9}, donde SA Metallic es el área de superficie metálica (m 2 /g de metal), SW Metal es el peso del metal activo, SF Calc es el factor estequiométrico calculado y SA Pd es la cruz área de sección de un átomo de paladio (nm 2). Así, en\ ref {10} obtenemos una superficie metálica de 2420.99 m 2 /g-metal.
\[ SA_{Metallic}\ =\ (\frac{V_{S}}{SW_{Metal}\ \times \ 22414})\ \times \ (SF_{Calc})\ \times \ (6.022\ \times \ 10^{23})\ \times \ SA_{Pd} \label{9} \]
\[ SA_{Metallic}\ =\ (\frac{0.8296556\ [cm^{3}]}{0.001289\ [g_{metal}]\ \times \ 22414\ [\frac{cm^{3}}{mol}]})\ \times \ (2)\ \times \ (6.022\ \times \ 10^{23}\ [\frac{atoms}{mol}])\ \times \ 0.07\ [\frac{nm^{2}}{atom}]\ =\ 2420.99\ [\frac{m^{2}}{g-metal}] \label{10} \]
Tamaño de partícula activo
El tamaño de partícula activa se estima usando\ ref {11}, donde D Calc es la densidad del metal paladio (g/cm 3), SW Metal es el peso del metal activo, GMW Calc es el peso molecular gramo calculado (g/g-mol), y SA Pd es el área de sección transversal de uno átomo de paladio (nm 2). Como se ve en\ ref {12} obtenemos un tamaño de partícula óptica de 2.88 nm.
\[ APS\ =\ \frac{6}{D_{Calc}\ \times \ (\frac{W_{S}}{GMW_{Calc}})\ \times \ (6.022\ \times \ 10^23)\ \times \ SA_{Metallic}} \label{11} \]
\[ APS\ =\ \frac{600}{(1.202\ \times \ 10^{-20} [\frac{g_{Pd}}{nm^{3}}])\ \times \ (\frac{0.001289\ [g]}{106.42\ [\frac{g_{Pd}}{mol}]})\ \times \ (6.022\ \times \ 10^{23}\ [\frac{atoms}{mol}])\ \times \ (2420.99\ [\frac{m^{2}}{g-Pd}])} \ =\ 2.88\ nm \label{12} \]
En un instrumento comercial, se proporcionará un informe resumido que resume las propiedades de nuestro material catalítico. Todas las ecuaciones utilizadas durante este ejemplo fueron extraídas del Manual del Usuario de AutoChem 2920-.
| Propiedades | Valor |
| Peso atómico de paladio | 106.4 g/mol |
| Área de sección transversal atómica | 0.0787 nm 2 |
| Densidad Metálica | 12.02 g/cm 3 |
| Carga de paladio | 1% en peso |
| Dispersión metálica | 6.03% |
| Superficie metálica | 2420.99 m 2 /g-metal |
| Diámetro de partícula activa (hemisferio) | 2.88 nm |


