6.1: Reacciones Reversibles y Equilibrios Químicos
- Page ID
- 75768
En 1798, el químico Claude Berthollet acompañó la expedición militar de Napoleón a Egipto. Mientras visitaba los Lagos Natron, una serie de lagos de agua salada tallados en piedra caliza, Berthollet hizo una observación que lo llevó a un importante descubrimiento. Al explorar la orilla del lago, Berthollet encontró depósitos de Na 2 CO 3, resultado que encontró sorprendente. ¿Por qué Berthollet encontró sorprendente este resultado y cómo contribuyó a un descubrimiento importante? Responder a estas preguntas nos proporciona un ejemplo de razonamiento químico y nos introduce en el tema de este capítulo.
La expedición de Napoleón a Egipto fue la primera en incluir una importante presencia científica. La Comisión de Ciencias y Artes, que incluía a Claude Berthollet, comenzó con 151 miembros, y operó en Egipto durante tres años. Además del trabajo de Berthollet, otros resultados incluyeron una publicación sobre espejismos y catálogos detallados de vida vegetal y animal, mineralogía y arqueología. Para una revisión de las contribuciones de la Comisión, véase Gillispie, C. G. “Aspectos científicos de la expedición egipcia francesa, 1798‐1801”, Proc. Am. Phil. Soc. 1989, 133, 447—474.
A finales del siglo XVIII se explicó la reactividad química en términos de afinidades electivas [Quilez, J. Chem. Educ. Res. Pract. 2004, 5, 69—87]. Si, por ejemplo, la sustancia A reacciona con la sustancia BC para formar AB
\[\text{A}+\text{BC} \rightarrow \text{AB}+\text{C} \nonumber\]
entonces A y B se dijo que tenían afinidad electiva el uno por el otro. Con la afinidad electiva como fuerza impulsora de la reactividad química, se entendió que las reacciones procedían a su finalización y procedían en una dirección. Una vez formado, el compuesto AB no pudo volver a A y BC.
\[\text{A}+\text{BC} \nrightarrow \text{AB}+\text{C} \nonumber\]
Por su experiencia en el laboratorio, Berthollet supo que al agregar Na 2 CO 3 sólido a una solución de CaCl 2 se produce un precipitado de CaCO 3.
\[\mathrm{Na}_{2} \mathrm{CO}_{3}(s)+\mathrm{CaCl}_{2}(a q) \rightarrow 2 \mathrm{NaCl}(a q)+\mathrm{CaCO}_{3}(s) \nonumber\]
Entendiendo esto, Berthollet se sorprendió al encontrar Na 2 CO 3 sólido que se formaba en los bordes del lago, particularmente porque los depósitos se formaron solo cuando el agua salada del lago, NaCl (aq), estaba en contacto con piedra caliza sólida, CaCo 3 (s). Donde el lago estaba en contacto con suelos arcillosos, había poco o nada de Na 2 CO 3.
Natron es otro nombre para el mineral carbonato de sodio, Na 2 CO 3 •10H 2 O. En la naturaleza, generalmente contiene impurezas de NaHCO 3 y NaCl. En el antiguo Egipto, el natrón se extraía y se usaba para una variedad de propósitos, incluso como agente de limpieza y en momificación.
La importante visión de Berthollet fue reconocer que la química que condujo a la formación de Na 2 CO 3 es la inversa de la observada en el laboratorio.
\[2 \mathrm{NaCl}(a q)+\mathrm{CaCO}_{3}(s) \rightarrow \mathrm{Na}_{2} \mathrm{CO}_{3}(s)+\mathrm{CaCl}_{2}(a q) \nonumber\]
Utilizando esta visión, Berthollet razonó que la reacción es reversible, y que las cantidades relativas de NaCl, CaCO 3, Na 2 CO 3 y CaCl 2 determinan la dirección en la que se produce la reacción y la composición final de la mezcla de reacción. Reconocemos la capacidad de una reacción para moverse en ambas direcciones usando una flecha doble cuando escribimos la reacción.
\[\mathrm{Na}_{2} \mathrm{CO}_{3}(s)+\mathrm{CaCl}_{2}(a q) \rightleftharpoons 2 \mathrm{NaCl}(a q)+\mathrm{CaCO}_{3}(s) \nonumber\]
Por razones obvias, llamamos a la flecha doble,\(\rightleftharpoons\), una flecha de equilibrio.
El razonamiento de Berthollet de que las reacciones son reversibles fue un paso importante en la comprensión de la reactividad química. Cuando mezclamos soluciones de Na 2 CO 3 y CaCl 2 reaccionan para producir NaCl y CaCO 3. A medida que se produce la reacción, si monitoreamos la masa de Ca 2 + que permanece en solución y la masa de CaCo 3 que precipita, el resultado se parece a la Figura 6.1.1 . Al inicio de la reacción la masa de Ca 2 + disminuye y la masa de CaCo 3 aumenta. Eventualmente la reacción alcanza un punto después del cual no hay más cambios en las cantidades de estas especies. Tal condición se llama estado de equilibrio.
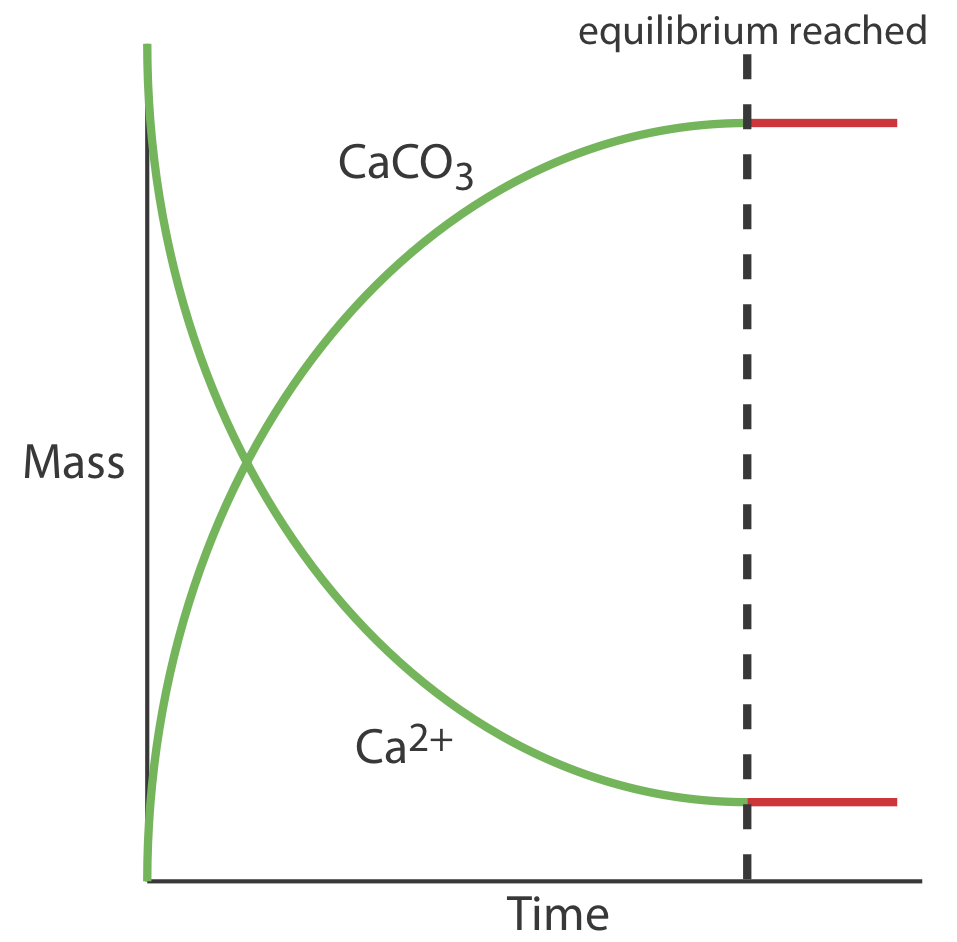
Si bien un sistema en equilibrio aparece estático a nivel macroscópico, es importante recordar que las reacciones hacia adelante y hacia atrás continúan ocurriendo. Una reacción en equilibrio existe en un estado estacionario, en el que la velocidad a la que se forma una especie es igual a la velocidad a la que se consume.


