11.1: Visión general de la electroquímica
- Page ID
- 75807
El enfoque de este capítulo está en técnicas analíticas que utilizan una medición de potencial, corriente o carga para determinar la concentración de un analito o para caracterizar la reactividad química de un analito. Colectivamente llamamos a esta área de la química analítica electroquímica porque se originó a partir del estudio del movimiento de electrones en una reacción de oxidación-reducción.
A pesar de la diferencia en la instrumentación, todas las técnicas electroquímicas comparten varias características comunes. Antes de considerar ejemplos individuales con mayor detalle, tomemos un momento para considerar algunas de estas similitudes. A medida que trabajas en el capítulo, este resumen te ayudará a enfocarte en similitudes entre diferentes métodos de análisis electroquímicos. Te resultará más fácil entender un nuevo método analítico cuando puedas ver su relación con otros métodos similares.
Cinco Conceptos Importantes
Para entender la electroquímica necesitamos apreciar cinco conceptos importantes e interrelacionados: (1) el potencial del electrodo determina la forma del analito en la superficie del electrodo; (2) la concentración de analito en la superficie del electrodo puede no ser la misma que su concentración en solución a granel; (3) en además de una reacción de oxidación-reducción, el analito puede participar en otras reacciones químicas; (4) la corriente es una medida de la velocidad de oxidación o reducción del analito; y (5) no podemos controlar simultáneamente la corriente y el potencial.
El material de esta sección, particularmente los cinco conceptos importantes, se basa en una visión para comprender la electroquímica descrita por Larry Faulkner en el artículo “Understanding Electrochemistry: Some Distinctive Concepts”, J. Chem. Educ. 1983, 60, 262—264. Véase también, Kissinger, P. T.; Bott, A. W. “Electroquímica para el no electroquímico”, Separaciones de corriente, 2002, 20:2, 51—53.
El potencial del electrodo determina la forma del analito
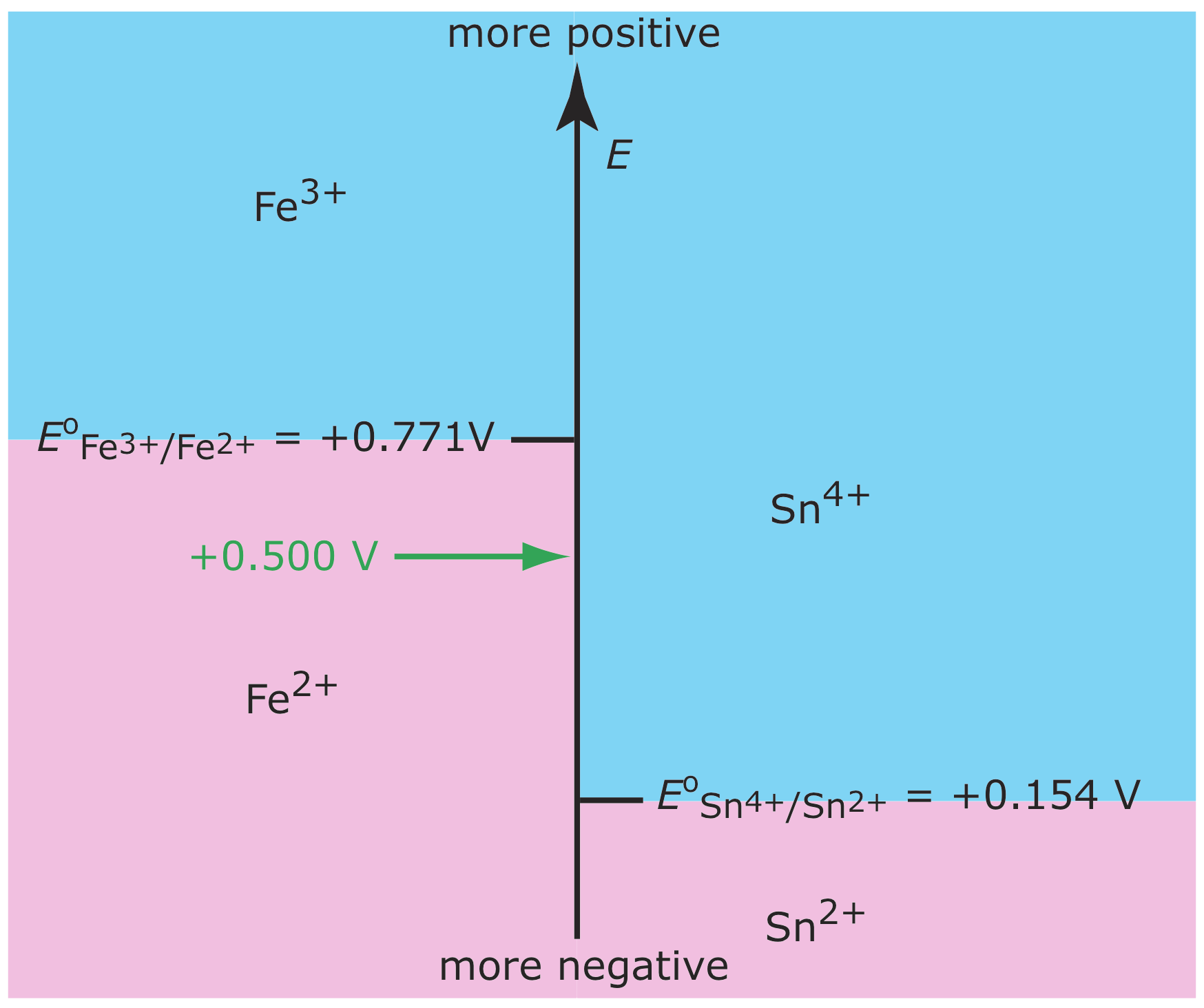
En el Capítulo 6 se introdujo el diagrama de escalera como una herramienta para predecir cómo un cambio en las condiciones de la solución afecta la posición de una reacción de equilibrio. La figura 11.1.1 , por ejemplo, muestra un diagrama de escalera para los equilibrios Fe 3 + /Fe 2+ y Sn 4+ /Sn 2+ y Sn 2+. Si colocamos un electrodo en una solución de Fe 3 + y Sn 4 + y ajustamos su potencial a +0.500 V, Fe 3 + se reduce a Fe 2 + pero Sn 4 + no se reduce a Sn 2 +.
Las concentraciones interfaciales pueden no ser iguales a las concentraciones a granel
En el Capítulo 6 se introdujo la ecuación de Nernst, que proporciona una relación matemática entre el potencial del electrodo y las concentraciones de las formas oxidadas y reducidas de un analito en solución. Por ejemplo, la ecuación de Nernst para Fe 3 + y Fe 2 + es
donde E es el potencial del electrodo y\(E_{\text{Fe}^{3+}/\text{Fe}^{2+}}^{\circ}\) es el potencial de reducción de estado estándar para la reacción\(\text{Fe}^{3+}(aq) \rightleftharpoons \text{ Fe}^{2+}(aq) + e^-\). Debido a que es el potencial del electrodo lo que determina la forma del analito en la superficie del electrodo, los términos de concentración en la Ecuación\ ref {11.1} son los de Fe 2 + y Fe 3 + en la superficie del electrodo, no sus concentraciones en solución a granel.
Esta distinción entre la concentración superficial de una especie y su concentración a granel es importante. Supongamos que colocamos un electrodo en una solución de Fe 3 + y fijamos su potencial a 1.00 V. A partir del diagrama de escalera en la Figura 11.1.1 , sabemos que Fe 3 + es estable a este potencial y, como se muestra en la Figura 11.1.2 a, el la concentración de Fe 3 + es la misma en todas las distancias de la superficie del electrodo. Si cambiamos el potencial del electrodo a +0.500 V, la concentración de Fe 3 + en la superficie del electrodo disminuye a aproximadamente cero. Como se muestra en la Figura 11.1.2 b, la concentración de Fe 3 + aumenta a medida que nos alejamos de la superficie del electrodo hasta que iguala la concentración de Fe 3 + en solución a granel. El gradiente de concentración resultante provoca que Fe 3 + adicional de la solución a granel se difunda a la superficie del electrodo.
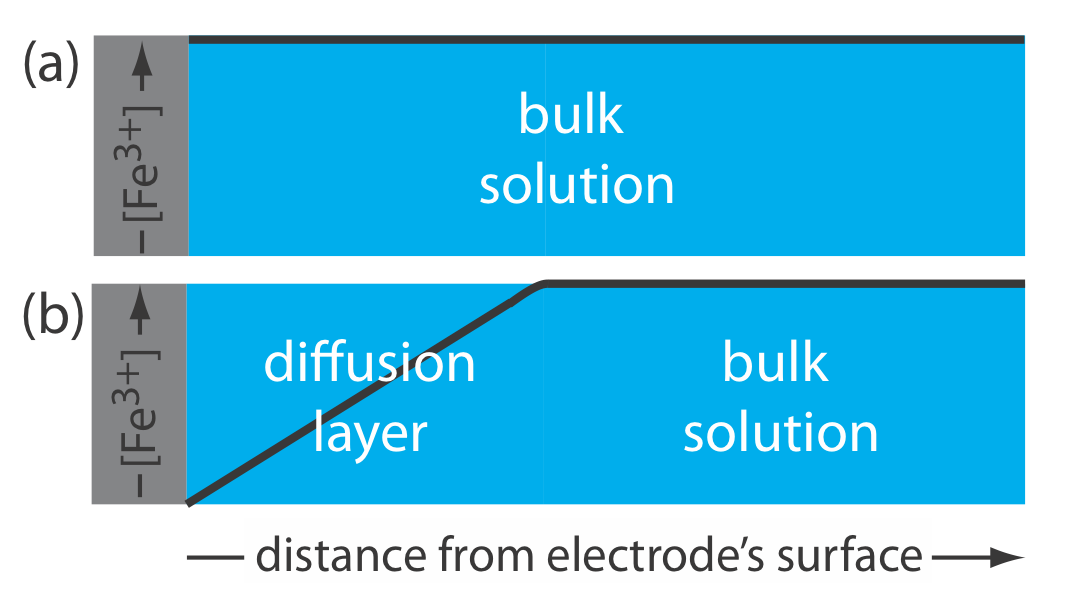
Llamamos a la región de solución que contiene este gradiente de concentración en Fe 3 + la capa de difusión. Tendremos más que decir sobre esto en el Capítulo 11.4.
El Análito Puede Participar en Otras Reacciones
La Figura 11.1.1 y la Figura 11.1.2 muestran cómo el potencial del electrodo afecta la concentración de Fe 3 + y cómo varía la concentración de Fe 3 + en función de la distancia desde la superficie del electrodo. La reducción de Fe 3 + a Fe 2 +, que se rige por la Ecuación\ ref {11.1}, puede no ser la única reacción que afecte la concentración de Fe 3 + en solución a granel o en la superficie del electrodo. La adsorción de Fe 3 + en la superficie del electrodo o la formación de un complejo metal-ligando en solución a granel, como Fe (OH) 2+, también afecta la concentración de Fe 3 +.
La corriente es una medida de la tasa
La reducción de Fe 3 + a Fe 2 + consume un electrón, el cual se extrae del electrodo. La oxidación de otra especie, tal vez el disolvente, en un segundo electrodo es la fuente de este electrón. Debido a que la reducción de Fe 3 + a Fe 2 + consume un electrón, el flujo de electrones entre los electrodos, es decir, la corriente, es una medida de la velocidad a la que se reduce Fe 3 +. Una consecuencia importante de esta observación es que la corriente es cero cuando la reacción\(\text{Fe}^{3+}(aq) \rightleftharpoons \text{ Fe}^{2+}(aq) + e^-\) está en equilibrio.
La velocidad de reacción\(\text{Fe}^{3+}(aq) \rightleftharpoons \text{ Fe}^{2+}(aq) + e^-\) es el cambio en la concentración de Fe 3 + en función del tiempo.
No podemos controlar simultáneamente tanto la corriente como el potencial
Si una solución de Fe 3 + y Fe 2 + está en equilibrio, la corriente es cero y el potencial viene dado por la Ecuación\ ref {11.1}. Si cambiamos el potencial lejos de su posición de equilibrio, la corriente fluye a medida que el sistema se mueve hacia su nueva posición de equilibrio. Aunque la corriente inicial es bastante grande, disminuye con el tiempo, llegando a cero cuando la reacción alcanza el equilibrio. La corriente, por lo tanto, cambia en respuesta al potencial aplicado. Alternativamente, podemos pasar una corriente fija a través de la celda electroquímica, forzando la reducción de Fe 3 + a Fe 2 +. Debido a que las concentraciones de Fe 3 + disminuyen y la concentración de Fe 2 + aumenta, el potencial, dado por la Ecuación\ ref {11.1}, también cambia con el tiempo. En definitiva, si elegimos controlar el potencial, entonces debemos aceptar la corriente resultante, y debemos aceptar el potencial resultante si elegimos controlar la corriente.
Controlar y medir corriente y potencial
Las mediciones electroquímicas se realizan en una celda electroquímica que consta de dos o más electrodos y los circuitos electrónicos necesarios para controlar y medir la corriente y el potencial. En esta sección presentamos los componentes básicos de la instrumentación electroquímica.
La celda electroquímica más simple utiliza dos electrodos. El potencial de un electrodo es sensible a la concentración del analito, y se llama electrodo de trabajo o electrodo indicador. El segundo electrodo, al que llamamos contraelectrodo, completa el circuito eléctrico y proporciona un potencial de referencia contra el cual medimos el potencial del electrodo de trabajo. Idealmente, el potencial del contraelectrodo permanece constante para que podamos asignar al electrodo de trabajo cualquier cambio en el potencial celular general. Si el potencial del contraelectrodo no es constante, entonces lo reemplazamos por dos electrodos: un electrodo de referencia cuyo potencial permanece constante y un electrodo auxiliar que completa el circuito eléctrico.
Debido a que no podemos controlar simultáneamente la corriente y el potencial, solo hay tres diseños experimentales básicos: (1) podemos medir el potencial cuando la corriente es cero, (2) podemos medir el potencial mientras controlamos la corriente, y (3) podemos medir la corriente mientras controlamos el potencial. Cada uno de estos diseños experimentales se basa en la ley de Ohm, que establece que la corriente, i, que pasa por un circuito eléctrico de resistencia, R, genera un potencial, E.
\[E = i R\nonumber\]
Cada uno de estos diseños experimentales utiliza un tipo diferente de instrumento. Para ayudarnos a entender cómo podemos controlar y medir la corriente y el potencial, describiremos estos instrumentos como si el analista los estuviera operando manualmente. Para ello, el analista observa un cambio en la corriente o el potencial y ajusta manualmente los ajustes del instrumento para mantener las condiciones experimentales deseadas. Es importante entender que los instrumentos electroquímicos modernos proporcionan un medio electrónico automatizado para controlar y medir la corriente y el potencial, y que lo hacen mediante el uso de circuitos electrónicos muy diferentes a los descritos aquí.
Este punto vale repetir: Es importante entender que los diseños experimentales de la Figura 11.1.3 , la Figura 11.1.4 y la Figura 11.1.5 no representan los instrumentos electroquímicos que encontrará en los laboratorios analíticos actuales. Para obtener más información sobre la instrumentación electroquímica moderna, consulte los recursos adicionales de este capítulo.
Potenciómetros
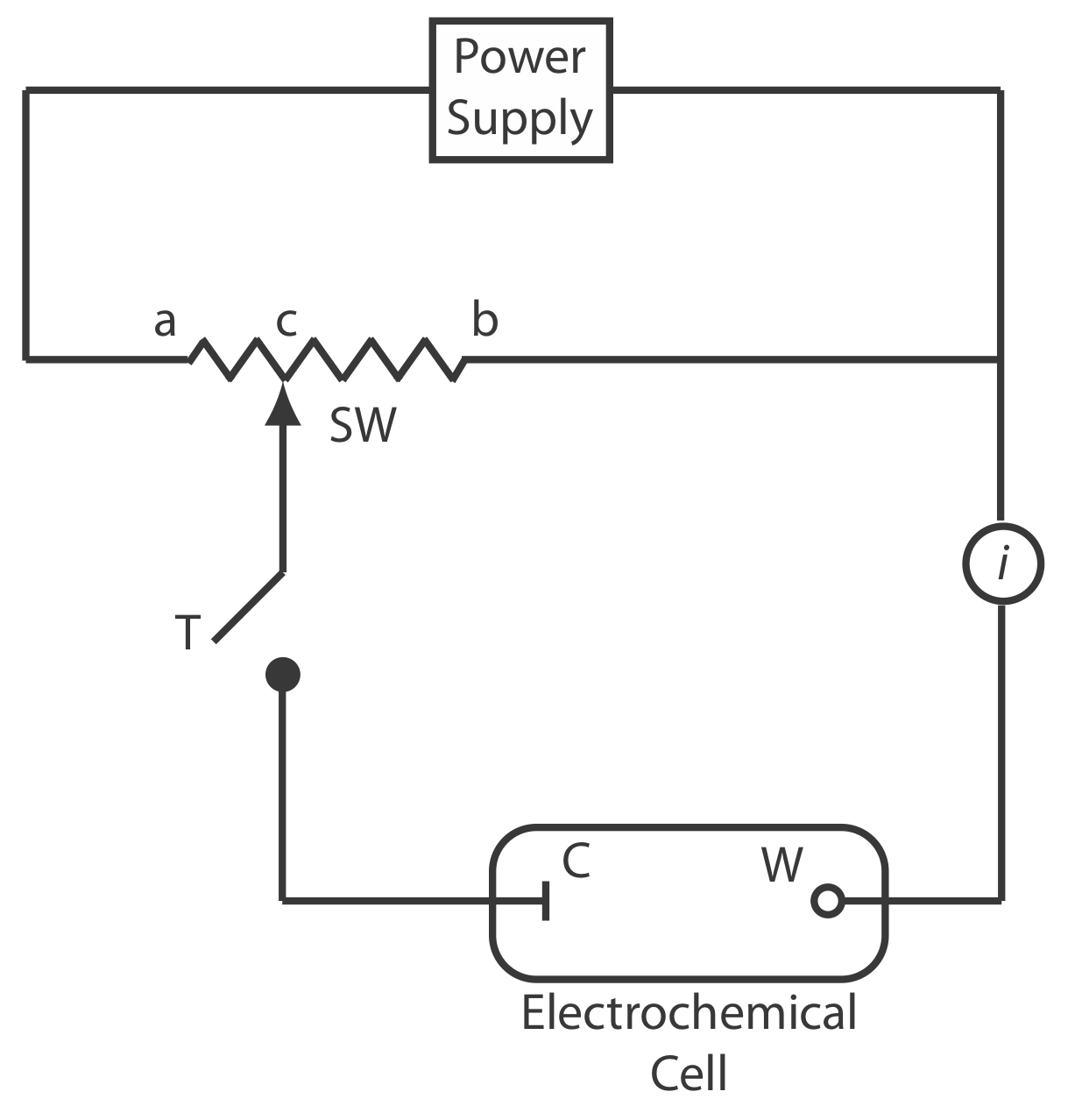
Para medir el potencial de una celda electroquímica bajo una condición de corriente cero utilizamos un potenciómetro. La Figura 11.1.3 muestra un diagrama esquemático de un potenciómetro manual que consiste en una fuente de alimentación, una celda electroquímica con un electrodo de trabajo y un contraelectrodo, un amperímetro para medir la corriente que pasa a través de la celda electroquímica, una resistencia ajustable de cable deslizante y una tecla tap para cerrar el circuito a través de la celda electroquímica. Usando la ley de Ohm, la corriente en la mitad superior del circuito es
\[i_{\text {upper}}=\frac{E_{\mathrm{PS}}}{R_{a b}} \nonumber\]
donde E PS es el potencial de la fuente de alimentación y R ab es la resistencia entre los puntos a y b de la resistencia de cable deslizante. De manera similar, la corriente en la mitad inferior del circuito es
\[i_{\text {lower}}=\frac{E_{\text {cell}}}{R_{c b}} \nonumber\]
donde la celda E es la diferencia de potencial entre el electrodo de trabajo y el contraelectrodo, y R cb es la resistencia entre los puntos c y b de la resistencia de cable deslizante. Cuando i superior = i inferior = 0, no fluye corriente a través del amperímetro y el potencial de la celda electroquímica es
\[E_{\mathrm{coll}}=\frac{R_{c b}}{R_{a b}} \times E_{\mathrm{PS}} \label{11.2}\]
Para determinar la celda E presionamos brevemente la tecla tap y observamos la corriente en el amperímetro. Si la corriente no es cero, entonces ajustamos la resistencia del cable deslizante y volvemos a medir la corriente, continuando con este proceso hasta que la corriente sea cero. Cuando la corriente es cero, usamos la Ecuación\ ref {11.2} para calcular la celda E.
El uso de la tecla tap para cerrar brevemente el circuito a través de la celda electroquímica minimiza la corriente que pasa a través de la celda y limita el cambio en la composición de la celda electroquímica. Por ejemplo, pasar una corriente de 10 —9 A a través de la celda electroquímica durante 1 s cambia las concentraciones de especies en la celda en aproximadamente 10 —14 moles. Los potenciómetros modernos utilizan amplificadores operacionales para crear un voltímetro de alta impedancia que mide el potencial mientras extrae una corriente de menos de 10 —9 A.
Galvanostatos
Un galvanostato, cuyo diagrama esquemático se muestra en la Figura 11.1.4 , nos permite controlar la corriente que fluye a través de una celda electroquímica. La corriente de la fuente de alimentación a través del electrodo de trabajo es
\[i=\frac{E_{\mathrm{PS}}}{R+R_{\mathrm{cell}}} \nonumber\]
donde E PS es el potencial de la fuente de alimentación, R es la resistencia de la resistencia y la celda R es la resistencia de la celda electroquímica. Si R >> celda R, entonces la corriente entre los electrodos auxiliar y de trabajo
\[i=\frac{E_{\mathrm{PS}}}{R} \approx \text{constant} \nonumber\]
mantiene un valor constante. Para monitorear el potencial del electrodo de trabajo, que cambia a medida que cambia la composición de la celda electroquímica, podemos incluir un electrodo de referencia opcional y un potenciómetro de alta impedancia.

Potenciostatos
Un potenciostato, cuyo diagrama esquemático se muestra en la Figura 11.1.5 , nos permite controlar el potencial del electrodo de trabajo. El potencial del electrodo de trabajo se mide en relación con un electrodo de referencia de potencial constante que se conecta al electrodo de trabajo a través de un potenciómetro de alta impedancia. Para establecer el potencial del electrodo de trabajo ajustamos la resistencia de cable deslizante que está conectada al electrodo auxiliar. Si el potencial del electrodo de trabajo comienza a derivar, ajustamos la resistencia del cable deslizante para devolver el potencial a su valor inicial. La corriente que fluye entre el electrodo auxiliar y el electrodo de trabajo se mide con un amperímetro. Los potenciostatos modernos incluyen generadores de forma de onda que nos permiten aplicar un perfil de potencial dependiente del tiempo, como una serie de pulsos de potencial, al electrodo de trabajo.

Técnicas Electroquímicas Interfaciales
Debido a que la electroquímica interfacial es un campo tan amplio, usemos Figure 11.1.6 para organizar las técnicas por las condiciones experimentales que elegimos usar (¿Controlamos el potencial o la corriente? ¿Cómo cambiamos el potencial aplicado o la corriente aplicada? ¿Agitamos la solución?) y la señal analítica que decidimos medir (Current? ¿Potencial?).
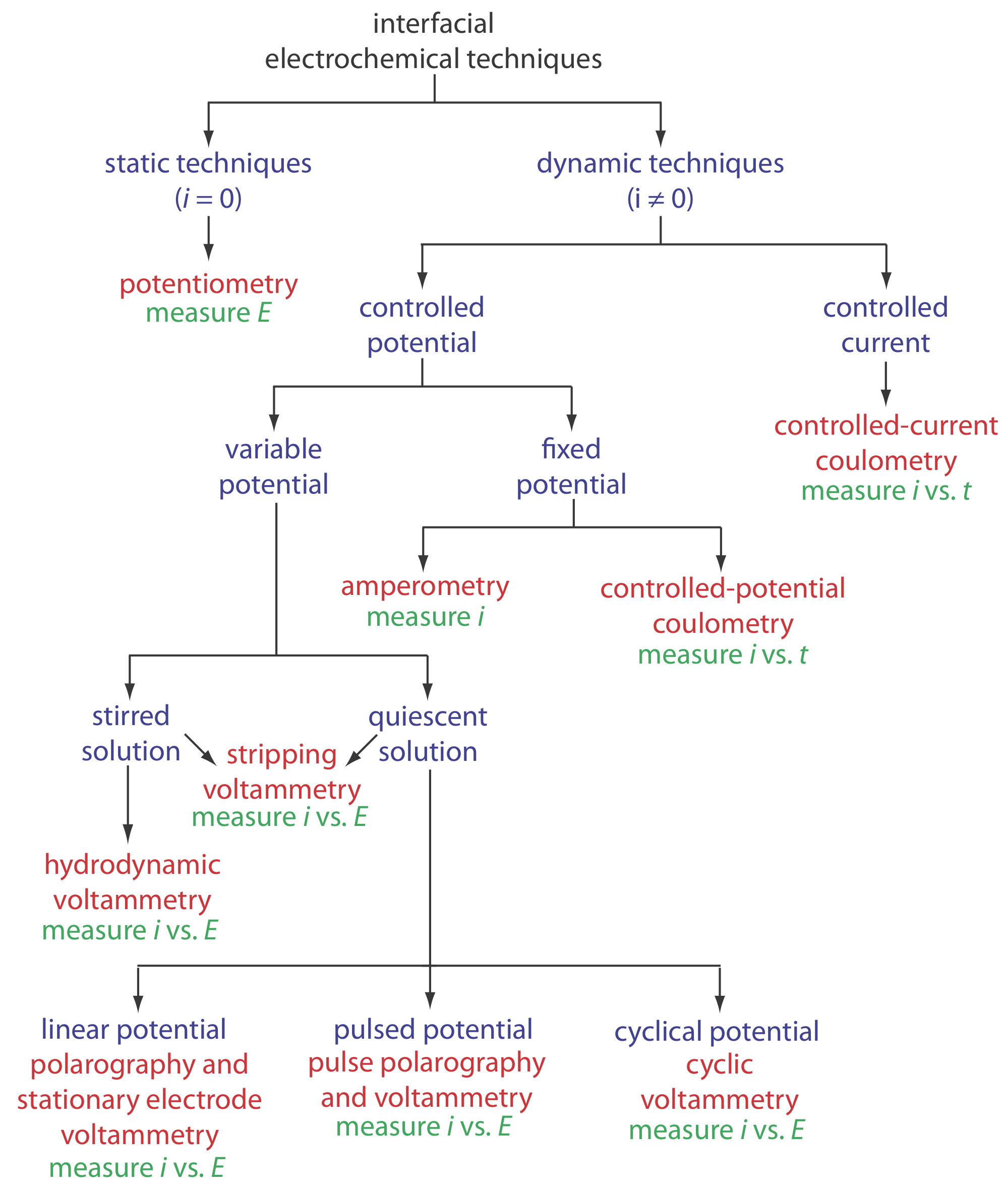
En el primer nivel, dividimos las técnicas electroquímicas interfaciales en técnicas estáticas y técnicas dinámicas. En una técnica estática no permitimos que la corriente pase a través de la celda electroquímica y, como resultado, las concentraciones de todas las especies permanecen constantes. La potenciometría, en la que medimos el potencial de una celda electroquímica en condiciones estáticas, es uno de los métodos electroquímicos cuantitativos más importantes y se discute en detalle en el Capítulo 11.2.
Las técnicas dinámicas, en las que permitimos que la corriente fluya y fuerce un cambio en la concentración de especies en la celda electroquímica, comprenden el mayor grupo de técnicas electroquímicas interfaciales. La culometría, en la que medimos la corriente en función del tiempo, está cubierta en el Capítulo 11.3. La amperometría y voltamperometría, en la que medimos la corriente en función de un potencial fijo o variable, es el tema del Capítulo 11.4.


