2.2: Gas de celosía ideal
- Page ID
- 69697
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Gas de celosía
La descripción de un fluido, gas, solución o mezcla que interactúa débilmente está dominada por la entropía traslacional o entropía de mezcla. En este caso, estamos tratando de cómo las moléculas ocupan un volumen, lo que conduce a una función de partición traduccional. Comenzamos definiendo una celosía y las moléculas que llenan esa celosía:

Parámetros:
Volumen total: Volumen\(V\)
celular:\(v\)
Número de sitios:\(M = V/v\)
Número de partículas: Factor de\(N\ (N \le M)\)
Relleno:\(x = N/M\ (0 \le x \le 1)\)
Número de contactos que tiene cada celda con celdas adyacentes:\(z\)
Comenzamos mi asumiendo que todos los microestados (configuraciones de sitios ocupados en el volumen) son igualmente probables, es decir,\(E_i = \text{constant}\). Este es el conjunto microcanónico, por lo que la entropía del fluido viene dada por la ecuación de Boltzmann
\[S=k_{B} \ln \Omega\]
donde\(\Omega\) está el número de microestados disponibles para el sistema. Si no\(M\) es igual a\(N\), entonces las permutaciones para poner partículas\(N\) indistinguibles en\(M\) sitios viene dada por la distribución binomial:
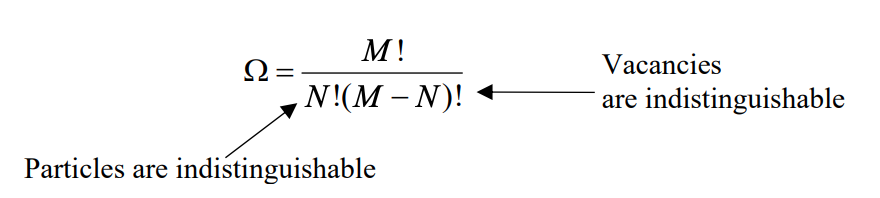
Además, en celosía cúbica, tenemos 6 contactos que cada celda hace con sus vecinos. El número de contacto es\(z\), que variará para\(2D\ (z = 4)\) y\(3D\ (z = 6)\) problemas.
¿Cómo elegimos la talla de\(v\)? Tiene que ser considerado caso por caso. El objetivo de estos modelos es tratar la célula como el volumen que una partícula excluye a la ocupación por otras partículas. Esto no necesita corresponder a una dimensión molecular real en el sentido atómico. En el caso de la derivación tradicional de la función de partición traslacional para un gas ideal,\(v\) es equivalente al volumen de cuantificación\(\Lambda^{3}=\left(h^{2} / 2 \pi m k_{B} T\right)^{3 / 2}\).
De\(\Omega\) podemos obtener la entropía de mezcla a partir\(S = k_B \ln \Omega\) de la ayuda de la aproximación de Sterling\(\ln (M !) \simeq M \ln (M) - M\):
\[\begin{array} {rcl} {S} & = & {k_B (M \ln M - N \ln N - (M - N) \ln (M - N))} \\ {} & = & {-Mk_B (x \ln x + (1 - x) \ln (1 - x))} \end{array}\]
En la última línea, introdujimos un factor de relleno de partículas
\[x = N/M \nonumber\]
que cuantifica la fracción de células que están ocupadas por partículas, y también se conoce como la fracción molar o la relación de empaquetamiento. Ya que\(x < 1\), la entropía de la mezcla siempre es positiva.
Para el caso de una solución diluida o gas\(N \ll M\), y\((1 - x) \approx 1\), así
\[S_{\text{dilute}} \approx -N k_B \ln x \ \ \ \ or \ \ \ \ -nR \ln x\nonumber\]
Podemos derivar la ley\(p = Nk_B T/V\) de gas ideal a partir de este resultado haciendo uso de la identidad termodinámica\(p = T (\partial S / \partial V)_N\).

