4.1: Solvación
- Page ID
- 69672
La solvatación describe las interacciones intermoleculares de una molécula o ion en solución con el disolvente circundante, que para nuestros fines se referirá al agua. La solvatación acuosa influye en una enorme gama de problemas en la biofísica molecular, incluyendo (1) transferencia de carga y estabilización de carga; (2) reactividad química y enzimática; (3) el efecto hidrófobo; (4) solubilidad, separación de fases y precipitación; (5) afinidad de unión; (6) autoensamblaje; y (7) procesos de transporte en agua. Los términos soluto y disolvente se aplican comúnmente a mezclas diluidas en la fase líquida en las que el soluto (componente menor) se dispersa en el disolvente (componente principal). Por esta razón, el concepto de solvatación también se extiende a veces para referirse a la influencia de cualquier entorno circundante en el que se incrusta una biomolécula, por ejemplo, una proteína o membrana.
Existen numerosos tipos de interacciones y efectos dinámicos que juegan un papel en la solvatación. Por lo general, las interacciones soluto-disolvente están dominadas por electrostáticos (interacciones de cargas, dipolos y dipolos inducidos), así como enlaces de hidrógeno y repulsión (ambos con componentes electrostáticos). Por lo tanto, existe una tendencia a pensar en la solvatación puramente en términos de estas energías de interacción electrostática. Una perspectiva común, la solvación polar, enfatiza cómo los dipolos de un líquido polar pueden realinearse para estabilizar energéticamente las cargas de solutos, como se ilustra aquí para el caso de la solvatación de iones en agua. El grado de estabilización del soluto en el líquido es la energía de reorganización.
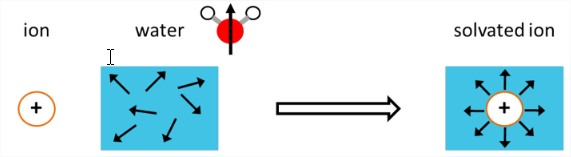
A diferencia de la mayoría de los solventes, la presencia de agua como solvente para moléculas biológicas cambia fundamentalmente sus propiedades y comportamiento a partir de la molécula aislada. Esto significa que el agua influye en la conformación de moléculas flexibles, y a veces las interacciones de enlaces de hidrógeno con el agua pueden ser lo suficientemente fuertes como para que sea difícil discernir dónde termina el límite del soluto y comienza el agua. Pero también hay un costo energético significativo al interrumpir la red de enlaces de hidrógeno del agua para insertar un soluto en el líquido. Además, la fluctuante red de enlaces de hidrógeno del agua introduce una entropía significativa en el sistema que puede ser competitiva o incluso el contribuyente dominante a la energía libre de solvatación. Como resultado, existen interacciones competitivas que involucran tanto el soluto como el agua que actúan para reestructurar el soluto y el solvente en relación con sus estructuras aisladas.
También es importante recordar que la solvatación es un proceso altamente dinámico. La dinámica de solvatación se refiere a los movimientos correlacionados dependientes del tiempo de soluto y disolvente. ¿Cómo se reorganiza un solvente en respuesta a cambios en la distribución o estructura de la carga de soluto? Por el contrario, ¿cómo influyen los cambios conformacionales en la configuración intermolecular del disolvente (i.e., flujo) los cambios en la estructura o distribución de carga en el soluto? Esta última perspectiva ve al soluto como “esclavizado” a la dinámica solvente. Estos procesos acoplados dan como resultado una amplia variedad de escalas de tiempo en la solvatación de macromoléculas biológicas que abarcan escalas de tiempo de\(10^{-14}\) a\(10^{-7}\) segundos..

