5.1: Solvación hidrofóbica - Termodinámica
- Page ID
- 69703
¿Por qué no se mezclan el aceite y el agua? ¿Qué es la hidrofobicidad? En primer lugar, el término es un nombre erróneo. Las moléculas grasientas que no se mezclan con el agua suelen tener energías de interacción favorables, es decir,\(∆H_{int} < 0\). Walter Kauzmann utilizó por primera vez el término “unión hidrófoba” en 1954. Este naming ha sido polémico desde el principio, pero presumiblemente se ha quedado atascado, porque en este caso\(\Delta G\) es lo que determina la afinidad de una sustancia por otra en lugar de solo\(\Delta H\). En términos generales, la entropía de la mezcla gobierna la observación de que dos líquidos que interactúan débilmente se mezclarán espontáneamente. Sin embargo, las interacciones intermoleculares del agua líquida son lo suficientemente fuertes como para preferir un enlace de hidrógeno consigo mismo que las moléculas no polares de solvato. Tratará de evitar interrumpir su red de enlaces de hidrógeno si es posible.
El efecto hidrofóbico se refiere a la penalización de energía libre que se paga para solvatar un soluto que interactúa débilmente. Refiriéndose al ciclo termodinámico anterior,\(\Delta G_{\text{sol}}\), el trabajo reversible necesario para solvatar una molécula hidrófoba, está dominado por el paso 1, el proceso de formación de una cavidad en el agua. La energía libre de solvatar un soluto hidrofóbico es grande y positiva, resultante de dos factores:
- \(\Delta G_{\text{sol}} < 0\). La penalización por entropía de crear una cavidad en el agua. Restringiremos el espacio configuracional disponible para el agua dentro de la cavidad. Este efecto y la entropía de mezcla (que se aplica a cualquier problema de solvatación) contribuyen a\(\Delta S_1\).
- \(\Delta G_{\text{sol}} > 0\). La penalización energética de romper la red de enlaces de hidrógeno (\(\Delta H _1\)) es el contribuyente dominante a la entalpía. Esto se puede estimar a partir de un recuento del número neto de enlaces H que deben romperse para acomodar el soluto:\(\Delta H_{\text{sol}}\) aumenta en 1-3 kcal mol\(^{-1}\) de enlaces de hidrógeno. La energía de interacción entre un hidrocarburo y agua (\(\Delta H_2\)) es débilmente favorable como resultado de las interacciones de dispersión, pero este es un efecto menor. (En contacto cercano, las fuerzas de van der Waals reducen la energía en\(\sim\) 0.1-1.0 kcal mol\(^{-1}\)). Por lo tanto\(\Delta H_{\text{sol}} \approx \Delta H_1\).
El resultado neto es que\(\Delta G_{\text{sol}}\) es grande y positivo, lo que se espera ya que el agua y el aceite no se mezclan.
Estas ideas fueron deducidas originalmente de la termodinámica clásica, y expuestas por Frank y Evans (1945) en el “modelo iceberg”, que sugería que el agua siempre buscaría cumplir tantos enlaces de hidrógeno como pudiera, envolviendo la red alrededor del soluto. Este es otro nombre erróneo, porque el efecto hidrofóbico es un problema límite sobre la reducción del espacio configuracional, no la congelación real de las fluctuaciones. Los enlaces de hidrógeno continúan rompiéndose y reformando en el líquido, pero existe un considerable espacio configuracional excluido para que esto ocurra. Pensemos en esto como una reorganización de la red de enlaces de hidrógeno inducida por solutos.
Entropía Configuracional de Agua
Hagamos una estimación de\(\Delta G_{\text{sol}}\). Cualitativamente, estamos hablando de limitar el espacio configuracional que las moléculas de agua pueden adoptar dentro de las limitaciones de un potencial tetraédrico.


Entonces, una estimación para la entropía de la solvatación hidrófoba si estas configuraciones son igualmente probables es\(\Delta S_{\text{sol}} = k_B \ln (\Omega_{\text{surf}} /\Omega_{\text{bulk}}) = -k \ln 2\) por enlace de hidrógeno del espacio configuracional perdido:
\[-T \Delta S_{\text{sol}}=k_{B} T \ln 2 \nonumber\]
Evaluando en\(300\ K\),
\[\begin{array} {rcl} {-T \Delta G_{\text{sol}}} & = & {1.7 \text{ kJ/mol water molecules @ 300 K}} \\ {} & = & {\text{0.4 kcal/mol water molecules}} \end{array}\nonumber\]
Este valor es menor que la entalpía típica para la formación de enlaces de hidrógeno, lo que es otra forma de decir que a los enlaces de hidrógeno les gusta permanecer en su mayoría intactos, pero tienen grandes fluctuaciones de amplitud.
Dependencia de temperatura de la solvatación hidrófoba
De\(\Delta S_{\text{sol}}\) esperamos\(\Delta G_{\text{sol}}\) subir con la temperatura como resultado del término entrópico. Esta es una firma clásica del efecto hidrofóbico: La fuerza que impulsa la condensación o la separación de fases aumenta con la temperatura. Dado que la conectividad de la fuerza del enlace de hidrógeno y las fluctuaciones en la red de enlaces de hidrógeno del agua cambian con la temperatura, la ponderación de los factores entálpicos y entrópicos en la solvatación hidrofóbica también varía con\(T\). Considere una dependencia típica de la temperatura\(\Delta G_{\text{sol}}\) para pequeñas moléculas hidrófobas:
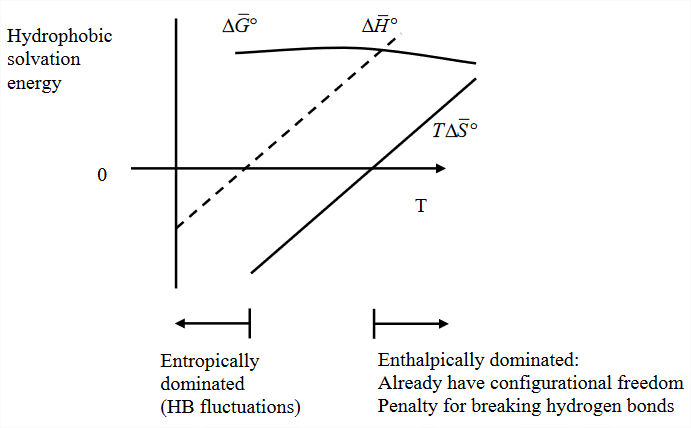
Las contribuciones entálpicas y entrópicas son dos efectos fuertemente dependientes de la temperatura, que compiten para dar como resultado una energía libre mucho más débilmente dependiente de la temperatura. Tenga en cuenta que esto es bastante diferente de la dependencia de la temperatura de los equilibrios químicos descritos por la ecuación de van't Hoff, que asume que\(\Delta H\) es independiente de la temperatura. La dependencia de la temperatura de todas estas variables puede describirse en términos de una gran capacidad calorífica positiva.
\[\begin{array} {rcl} {\Delta C_{\text{p, sol}}} & = & {\dfrac{\partial \Delta H_{\text{sol}}^0}{\partial T} = T\dfrac{\partial \Delta S_{\text{sol}}^0}{\partial T}} \\ {} & = & {-T \dfrac{\partial^2 G_{\text{sol}}^0}{\partial T^2} \ \ \ \ (\text{Curvature of } \Delta G^0)} \end{array} \nonumber\]
A bajas temperaturas, con una red de enlaces de hidrógeno más fuerte y rígida, domina el\(\Delta S\) término. Pero a altas temperaturas, acercándose a la ebullición, la penalización entrópica es mucho menor.

