5.2: Solvación hidrofóbica - Efecto Tamaño del Soluto
- Page ID
- 69696
Para crear una nueva interfaz hay penalizaciones entálpicas y entrópicas. La influencia de cada uno de estos factores depende del tamaño del soluto (R) relativo a la escala de la estructura de enlaces de hidrógeno en el líquido (longitud de correlación\(\ell\),, ~0.5—1.0 nm).
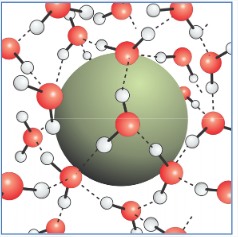
Para solutos pequeños (\(R < \ell\)): Deformación de la red
El soluto puede insertarse en la red de enlaces de hidrógeno sin romper los enlaces de hidrógeno. Puede tensar los HBs (\(\Delta H > 0\)) y reducir la entropía configuracional (\(\Delta S < 0\)), pero el líquido en su mayoría mantiene intactos los enlaces de hidrógeno. Esperamos que la energía libre de este proceso escale como volumen del soluto\(\Delta G_{\text{sol}} (R < \ell) \propto R^3\).
Para solutos grandes\(R > \ell\): Creación de una interfaz
La red de enlaces de hidrógeno ya no puede mantener todos sus HBs entre las moléculas de agua. El estado de baja energía implica enlaces de hidrógeno colgando en la superficie. Una de cada tres moléculas de agua superficial tiene un enlace de hidrógeno colgando, es decir, en promedio cinco de seis enlaces de hidrógeno de la masa se mantienen en la interfaz.
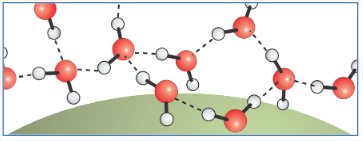
Esperamos\(\Delta G_{\text{sol}}\) escalar como el área de superficie\(\Delta G_{\text{sol}} (R > \ell) \propto R^2\). Por supuesto, los solutos grandes también tienen un término de desplazamiento de gran volumen. Dado que el sistema siempre buscará minimizar la energía libre, habrá un punto en el que el\(R^3\) término crezca más rápido con radio de soluto que el\(R^2\) término, por lo que los solutos grandes están dominados por el término superficial.
Cálculo\(\Delta G\) para la formación de una cavidad en el agua
Investiguemos la energía requerida para formar cavidades en el agua utilizando un enfoque puramente termodinámico. Para poner una cavidad grande (\(R > \ell\)) en el agua, estamos creando una nueva interfaz líquido-vapor para la cavidad. Así podemos calcular la energía para crear una cavidad utilizando la tensión superficial del agua. Termodinámicamente, la tensión superficial\(\gamma\) es la energía requerida para deformar una interfaz líquido-vapor:\(\gamma=(\partial U / \partial a)_{N, V, T}\), dónde\(a\) está el área superficial. Así podemos escribir el cambio de energía como resultado de insertar una cavidad esférica en el agua como producto de la tensión superficial del agua multiplicada por la superficie de la cavidad,
\[U(R)=4 \pi R^{2} \gamma \nonumber\]
En principio, lo determinado experimentalmente\(\gamma\) debe incluir contribuciones entrópicas y entálpicas para alterar la red de enlaces de hidrógeno en una superficie, por lo que asociamos esto con\(\Delta G_{\text{sol}}\). Para el agua en\(300\ K\),\(\gamma = 72\ pN/nm\). \(\gamma\)varía de\(75\ pN/nm\)\(0\ ^{\circ}C\) a\(60\ pN/nm\) en\(100\ ^{\circ}C\).
La tensión superficial también puede considerarse una energía superficial por unidad de área: que también puede considerarse una energía superficial, es decir,\(\gamma = 72\ mJ/m^2\). Para relacionarlo con una cantidad a escala molecular, podemos estimar el área superficial por molécula de agua en una cavidad esférica. El volumen molecular del agua a granel deducido de su densidad es\(3.0 \times 10^{-26}\ \text{L/molecule}\), y la superficie correspondiente por molécula deducida de argumentos geométricos es\(\sim 10 \mathring{A}^2\). Esta área nos permite expresarnos\(\gamma \approx 4.3\ kJ/mol\), que está en el orden de la fuerza de los enlaces de hidrógeno en el agua.
Para cavidades pequeñas (\(R < \ell\)), las consideraciones son diferentes ya que no estamos rompiendo enlaces de hidrógeno. Aquí solo estamos limitando el espacio configuracional de la cavidad y la interfaz, que debería escalar como volumen. Definimos
\[\Delta G_{\text{sol}}(R < \ell) = \dfrac{4 \pi R^{3}}{3} \rho_{E} \nonumber\]
donde\(\rho_E\) es una densidad de energía 1.
\[\rho_{E} \approx 240 \times 10^{-9} \ pJ/nm^{3} = 240 \ pN/nm^{-2}\nonumber\]
Recordando eso\(-\partial G /\left.\partial V\right|_{N, T}=p\), la densidad de energía corresponde a unidades de presión con un valor\(\rho_E = 2.4 \times 10^3\) atm. Si dividimos\(\rho_E\) por la molaridad del agua (55M), entonces encontramos que se puede expresar como\(4.4\ kJ/mol\), similar al valor de energía libre de superficie deducido.
Así que combinando los términos de superficie y volumen que escribimos
\[\Delta G_{\text{sol}}(R)=4 \pi \gamma R^{2}+\dfrac{4}{3} \pi R^{3} \rho_{E}\nonumber\]
Alternativamente, podemos definir una escala de longitud efectiva (radio) para el escalado de esta interacción
\[\dfrac{\Delta G_{\text{sol}}}{k_{B} T} = \left ( \dfrac{R}{R_{\text{surf}}} \right )^{2} + \left (\dfrac{R}{R_{V}} \right) ^{3} \quad \quad \quad R_{\text{surf}}=\sqrt{\dfrac{k_{B} T}{4 \pi \gamma}} \quad R_{V} = \left (\dfrac{3 k_{B} T}{4 \pi \rho_{E}} \right)^{1/3} \nonumber\]
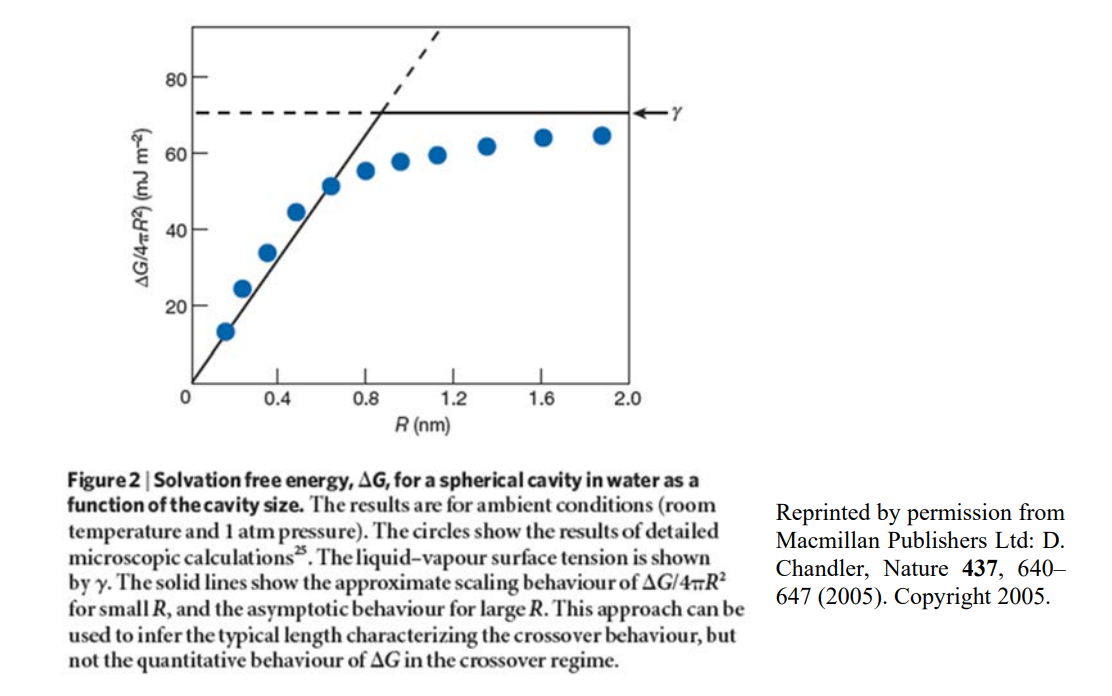
dónde\(R_{\text{surf}} = 0.067\ nm\) y\(R_V = 1.6\ nm\) en\(300\ K\). Podemos evaluar el cruce de efectos de solvatación hidrofóbica dominados por volumen a dominados por área estableciendo estos términos iguales y encontrando que esto ocurre cuando\(R = 3\gamma /\rho_E = 0.9\ nm\). La siguiente figura ilustra este comportamiento y lo compara con los resultados de simulaciones MD de una esfera en el agua.
Un enfoque alternativo para describir la energía molar libre de solvatación para una esfera hidrofóbica de radio la\(r\) equipara con la probabilidad de encontrar una cavidad de radio\(r\):
\[\Delta G = -k_B T \ln P(r)\nonumber\]
\[\begin{array} {rcl} {P(r)} & = & {\dfrac{e^{-U(r)/k_B T}}{\int_0^{\infty} e^{-U(r)/k_B T} dr} = \dfrac{\exp \left [\dfrac{-4\pi \gamma r^2}{k_B T} \right]}{\dfrac{1}{2} \sqrt{\dfrac{k_B T}{4\gamma}}}} \\ {} & = & {\dfrac{2}{\sqrt{\pi} R_{\text{surf}}} \exp [-r^2/R_{\text{surf}}^2]} \end{array} \nonumber\]
Esto lleva a una expresión muy parecida a la que describimos anteriormente para las cavidades grandes. Es instructivo determinar para el agua @\(300\ K\):
\[\langle r\rangle=\int_{0}^{\infty} dr\ r\ P(r)=\pi^{-1 / 2} R_{\text{suff}}=\dfrac{1}{2 \pi} \left (\dfrac{k_{B} T}{\gamma} \right)^{1/2}=0.038\ nm \nonumber\]
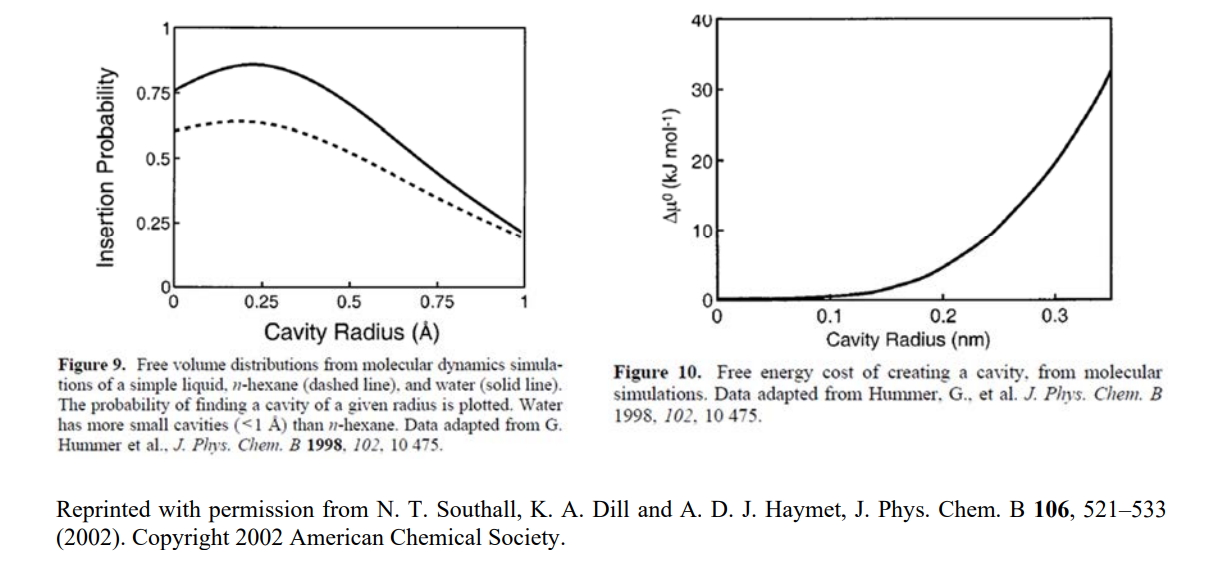
Esto es muy pequeño, pero concuerda bien con las simulaciones. (¡No hay mucho volumen libre en el agua!) No obstante, cuando repites esto para encontrar la varianza en el tamaño de las cavidades\(\delta r = (\langle r^2 \rangle - \langle r \rangle^2)^{1/2}\), nos encontramos\(\delta r = 0.028\ nm\). Entonces las fluctuaciones de tamaño son de la misma escala que el promedio y por lo tanto bastante grandes en un sentido relativo, pero aún menores que el tamaño de una molécula de agua.
Las simulaciones dan la distribución de equilibrio de las cavidades en el agua
\[\Delta \mu^0 = -k_B T \ln (P) \nonumber\]
_______________________________________
- D. Chandler, Interfaces y la fuerza impulsora del ensamblaje hidrofóbico, Nature 437, 640—647 (2005).

