5.2: Espectroscopia electrónica de barrena
- Page ID
- 69037
La espectroscopia electrónica de barrena (Auger spectroscopy o AES) se desarrolló a finales de la década de 1960, derivando su nombre del efecto observado por primera vez por Pierre Auger, un físico francés, a mediados de la década de 1920, es una técnica específica de superficie que utiliza la emisión de electrones de baja energía en el Auger y es una de las técnicas analíticas de superficie más utilizadas para determinar la composición de las capas superficiales de una muestra.
La espectroscopia de barrena se puede considerar como que involucra tres pasos básicos:
- Ionización atómica (por eliminación de un electrón central)
- Emisión de electrones (el proceso Auger)
- Análisis de los electrones Auger emitidos
La última etapa es simplemente un problema técnico de detectar partículas cargadas con alta sensibilidad, con el requisito adicional de que se deben determinar las energías cinéticas de los electrones emitidos. Por lo tanto, nos ocuparemos únicamente de los dos primeros procesos, antes de comenzar, sin embargo, es útil revisar brevemente la estructura electrónica de átomos y sólidos, y la nomenclatura asociada.
Estructura Electrónica - Átomos Aislados
El siguiente diagrama ilustra esquemáticamente las energías de los diversos niveles de energía electrónica en un átomo aislado de múltiples electrones, con la nomenclatura química convencional para estos orbitales dada en el lado derecho.
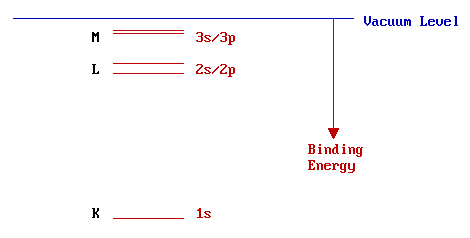
Sin embargo, los científicos que trabajan con rayos X tienden a utilizar la nomenclatura alternativa de la izquierda y es esta nomenclatura la que se utiliza en la espectroscopia Auger. La designación de niveles a los proyectiles K, L, M,... se basa en que tengan números cuánticos principales de 1,2,3,... respectivamente. Es conveniente ampliar la parte de la escala de energía cerca del nivel de vacío con el fin de distinguir más claramente entre los niveles superiores...
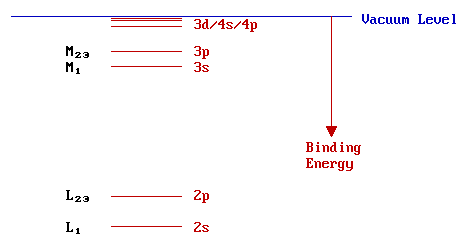
El componente numérico del KLM.. estilo de nomenclatura generalmente se escribe como un subíndice inmediatamente después de la designación de shell principal. Los niveles con un valor distinto de cero del número cuántico de momento angular orbital (l > 0), es decir, p, d, f,.. niveles, muestran división de espín-órbita. La magnitud de esta división, sin embargo, es demasiado pequeña para ser evidente en este diagrama, de ahí que el doble subíndice para estos niveles (es decir, L 2,3 representa tanto los niveles L 2 como L 3).
Estructura Electrónica - Estado Sólido
En estado sólido, los niveles centrales de átomos son poco perturbados y esencialmente permanecen como niveles discretos, localizados (es decir, atómicos). Los orbitales de valencia, sin embargo, se superponen significativamente con los de los átomos vecinos generando bandas de niveles de energía espacialmente deslocalizados. El diagrama de niveles de energía para el sólido es, por lo tanto, muy parecido al del átomo aislado correspondiente, a excepción de los niveles más cercanos al nivel de vacío. El siguiente diagrama muestra la estructura electrónica del metal Na:

El proceso de barrena y la espectroscopia de barrena
Ahora volvamos al tema de la espectroscopia Auger - en la siguiente discusión, el proceso Auger se ilustra utilizando los niveles K, L 1 y L 2,3. Estos podrían ser los niveles del núcleo interno de un átomo en un ambiente molecular o de estado sólido.
Paso I: Ionización
El proceso Auger se inicia mediante la creación de un agujero central - esto se lleva a cabo típicamente exponiendo la muestra a un haz de electrones de alta energía (que típicamente tiene una energía primaria en el rango de 2 - 10 keV). Dichos electrones tienen suficiente energía para ionizar todos los niveles de los elementos más ligeros, y niveles centrales más altos de los elementos más pesados.
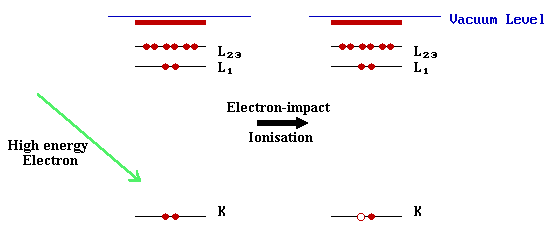
En el diagrama anterior, se muestra que la ionización ocurre mediante la eliminación de un electrón de capa K, pero en la práctica dicho método crudo de ionización conducirá a iones con agujeros en una variedad de niveles de cubierta interna.
En algunos estudios, el proceso de ionización inicial se lleva a cabo utilizando rayos X blandos (h ν = 1000 - 2000 eV). En este caso, a veces se utiliza el acrónimo XAES. Como veremos, sin embargo, este cambio en el método de ionización no tiene un efecto significativo sobre el espectro final de Auger.
Paso II: Relajación y emisión de barrena
El átomo ionizado que permanece después de la eliminación del electrón del agujero central se encuentra, por supuesto, en un estado altamente excitado y se relajará rápidamente de nuevo a un estado de energía más baja por una de dos vías: fluorescencia de rayos X o emisión de Auger. Solo consideraremos este último mecanismo, ejemplo del cual se ilustra esquemáticamente a continuación...
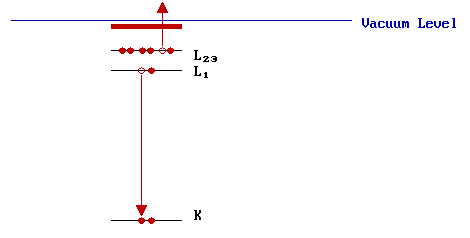
En este ejemplo, un electrón cae de un nivel superior para llenar un agujero de núcleo inicial en la carcasa K y la energía liberada en este proceso se transfiere simultáneamente a un segundo electrón; se requiere una fracción de esta energía para superar la energía de unión de este segundo electrón, el resto se retiene por este electrón Auger emitido como energía cinética. En el proceso de Auger ilustrado, el estado final es un átomo doblemente ionizado con agujeros centrales en las conchas L 1 y L 2,3.
Podemos hacer una estimación aproximada del KE del electrón Auger a partir de las energías de unión de los diversos niveles involucrados. En este ejemplo particular,
\[KE = ( E_K - E_{L1} ) - E_{L23} \label{eq1}\]
[¿Por qué no es probable que esta respuesta sea muy precisa?]
Nota: el KE del electrón Auger es independiente del mecanismo de formación inicial del agujero del núcleo.
La ecuación\ ref {eq1} también se puede reescribir en la forma:
\[KE = E_K - ( E_{L1} + E_{L23} )\]
Debe quedar claro a partir de esta expresión que estos dos últimos términos energéticos podrían intercambiarse sin ningún efecto, es decir, en realidad es imposible decir qué electrón llena el agujero del núcleo inicial y cuál es expulsado como un electrón Auger; son indistinguibles.
Por lo tanto, una transición de barrena se caracteriza principalmente por:
- la ubicación del agujero inicial
- la ubicación de los dos hoyos finales
aunque la existencia de diferentes estados electrónicos (términos) del átomo final doblemente ionizado puede conducir a una estructura fina en espectros de alta resolución.
Paso III: Análisis e Interpretación
Al describir la transición, se da primero la ubicación inicial del orificio, seguida de las ubicaciones de los dos orificios finales en orden de disminución de la energía de unión, es decir, la transición ilustrada es una transición KL 1 L 2 ,3. Si solo consideramos estos tres niveles electrónicos hay claramente varias transiciones posibles de Auger: específicamente,
| K L 1 L 1 | K L 1 L 2,3 | K L 2,3 L 2,3 |
En general, dado que la ionización inicial no es selectiva y el orificio inicial puede, por lo tanto, estar en varias conchas, habrá muchas transiciones posibles de Auger para un elemento dado, algunas débiles, algunas fuertes en intensidad. La ESPECTROSCOPIA AUGER se basa en la medición de las energías cinéticas de los electrones emitidos. Cada elemento de una muestra en estudio dará lugar a un espectro característico de picos a diversas energías cinéticas.
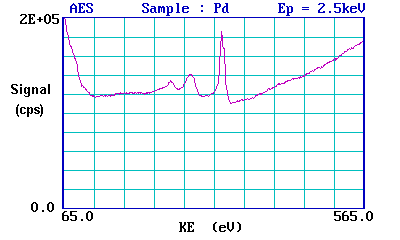
Este es un espectro Auger de metal Pd, generado usando un haz de electrones de 2.5 keV para producir las vacantes iniciales del núcleo y, por lo tanto, estimular el proceso de emisión de Auger. Los picos principales para el paladio ocurren entre 220 y 340 eV. Los picos se sitúan sobre un fondo alto que surge del vasto número de llamados electrones secundarios generados por una multitud de procesos de dispersión inelástica.
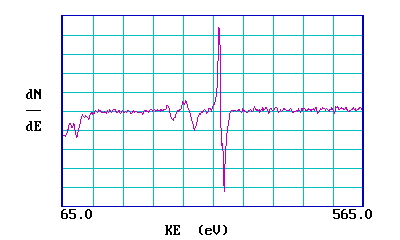
Los espectros de barrena también se muestran a menudo en una forma diferenciada: las razones de esto son en parte históricas, en parte porque es posible medir espectros directamente en esta forma y al hacerlo obtener una mejor sensibilidad para la detección. La siguiente gráfica muestra el mismo espectro en una forma tan diferenciada.
Resumen
La Espectroscopia Electrónica Auger (AES) es una técnica espectroscópica sensible a la superficie utilizada para el análisis elemental de superficies; ofrece
- alta sensibilidad (típicamente ca. 1% monocapa) para todos los elementos excepto H y He.
- un medio para monitorear la limpieza de la superficie de las muestras
- análisis cuantitativo de la composición de la región superficial de especímenes, mediante comparación con muestras estándar de composición conocida.
Además, la técnica básica también se ha adaptado para su uso en:
- Perfilado de profundidad de barrena: proporciona información cuantitativa de composición en función de la profundidad debajo de la superficie
- Microscopía de barrena de barrido (SAM): proporciona información composicional espacialmente resuelta sobre muestras heterogéneas


