5.3: Espectroscopia fotoelectrónica
- Page ID
- 69038
La espectroscopia fotoelectrónica utiliza fotoionización y análisis de la distribución de energía cinética de los fotoelectrones emitidos para estudiar la composición y el estado electrónico de la región superficial de una muestra. Tradicionalmente, cuando la técnica se ha utilizado para estudios de superficie se ha subdividido según la fuente de radiación excitante en:
- Espectroscopia Fotoelectrónica de Rayos X (XPS): usando rayos X blandos (con una energía fotónica de 200-2000 eV) para examinar los niveles centrales.
- Espectroscopia Fotoelectrónica Ultravioleta (UPS): usando radiación UV de vacío (con una energía fotónica de 10-45 eV) para examinar los niveles de valencia.
El desarrollo de fuentes de radiación sincrotrón ha permitido realizar estudios de alta resolución con radiación que abarca un rango de energía mucho más amplio y completo (5 - 5000+ eV) pero dicho trabajo sigue siendo una pequeña minoría de todos los estudios fotoelectrónicos debido al gasto, complejidad y disponibilidad limitada de tales fuentes.
Principios Físicos
La espectroscopia fotoelectrónica se basa en un solo proceso de entrada/salida de fotones y desde muchos puntos de vista este proceso subyacente es un fenómeno mucho más simple que el proceso Auger. La energía de un fotón de todo tipo de radiación electromagnética viene dada por la relación de Einstein:
\[E = h \nu \label{5.3.1}\]
donde\(h\) es constante de Planck (6.62 x 10 -34 J s) y\(\nu\) es th e frecuencia (Hz) de la radiación.
La espectroscopia fotoelectrónica utiliza fuentes monocromáticas de radiación (es decir, fotones de energía fija). En XPS, el fotón es absorbido por un átomo en una molécula o sólido, lo que lleva a la ionización y la emisión de un electrón central (capa interna). Por el contrario, en UPS el fotón interactúa con los niveles de valencia de la molécula o sólido, conduciendo a la ionización por eliminación de uno de estos electrones de valencia. La distribución de energía cinética de los fotoelectrones emitidos (es decir, el número de fotoelectrones emitidos en función de su energía cinética) se puede medir usando cualquier analizador de energía electrónica apropiado y así se puede registrar un espectro de fotoelectrones. El proceso de fotoionización se puede considerar de varias maneras: una forma es mirar el proceso general de la siguiente manera:
\[A + hν \rightarrow A^+ + e^- \label{5.3.2}\]
La conservación de la energía requiere entonces que:
\[E(A) + h\nu = E(A^+ ) + E(e^-) \label{5.3.3}\]
Dado que la energía del electrón está presente únicamente como energía cinética (KE), esta puede reorganizarse para dar la siguiente expresión para el KE del fotoelectrón:
\[KE = h\nu - ( E(A^+ ) - E(A) )\label{5.3.4}\]
El término final entre paréntesis, que representa la diferencia de energía entre los átomos ionizados y neutros, generalmente se llama la energía de unión (BE) del electrón; esto luego conduce a la siguiente ecuación comúnmente citada:
\[KE = h\nu - BE \label{5.3.5}\]
Un enfoque alternativo es considerar un modelo de un electrón siguiendo las líneas de la siguiente representación pictórica; este modelo del proceso tiene el beneficio de la simplicidad pero puede ser bastante engañoso.

El BE ahora se toma como una medida directa de la energía requerida para simplemente eliminar el electrón en cuestión de su nivel inicial al nivel de vacío y el KE del fotoelectrón viene nuevamente dado por:
\[KE = hν - BE \label{5.3.6}\]
Las energías de unión (BE) de los niveles de energía en los sólidos se miden convencionalmente con respecto al nivel de Fermi del sólido, en lugar del nivel de vacío. Esto implica una pequeña corrección a la Ecuación\ ref {5.3.6} para dar cuenta de la función de trabajo (\(φ\)) del sólido. Para los efectos de la discusión a continuación se descuidará esta corrección.
Detalles Experimentales
Los requisitos básicos para un experimento de fotoemisión (XPS o UPS) son:
- una fuente de radiación de energía fija (una fuente de rayos X para XPS o, típicamente, una lámpara de descarga He para UPS)
- un analizador de energía electrónica (que puede dispersar los electrones emitidos de acuerdo con su energía cinética, y de ese modo medir el flujo de electrones emitidos de una energía particular)
- un entorno de alto vacío (para permitir que los fotoelectrones emitidos sean analizados sin interferencia de colisiones de fase gaseosa)
Un sistema de este tipo se ilustra esquemáticamente a continuación:
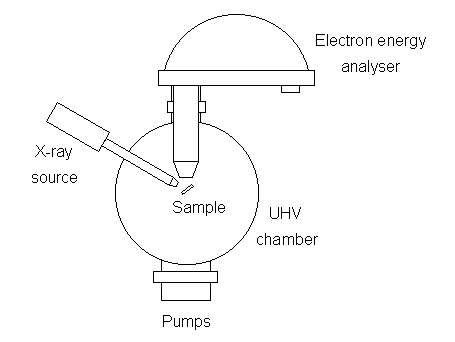
Hay muchos diseños diferentes de analizador de energía electrónica, pero la opción preferida para los experimentos de fotoemisión es un analizador hemisférico concéntrico (CHA) que utiliza un campo eléctrico entre dos superficies hemisféricas para dispersar los electrones de acuerdo con su energía cinética.
Espectroscopia fotoelectrónica de rayos X (XPS)
Para todos y cada uno de los elementos, habrá una energía de unión característica asociada con cada núcleo orbital atómico, es decir, cada elemento dará lugar a un conjunto característico de picos en el espectro de fotoelectrones a energías cinéticas determinadas por la energía fotónica y las respectivas energías de unión. Por lo tanto, la presencia de picos a energías particulares indica la presencia de un elemento específico en la muestra en estudio; además, la intensidad de los picos está relacionada con la concentración del elemento dentro de la región muestreada. Así, la técnica proporciona un análisis cuantitativo de la composición de la superficie y a veces es conocida por el acrónimo alternativo, ESCA (pectroscopia E lectron S para nálisis C hemical A). Las fuentes de rayos X más utilizadas son las que dan lugar a:
- Radiación Mg K α: h ν = 1253.6 eV
- Radiación Al K α: h ν = 1486.6 eV
Por lo tanto, los fotoelectrones emitidos tendrán energías cinéticas en el rango de ca. 0 - 1250 eV o 0 - 1480 eV. Dado que tales electrones tienen IMFP muy cortos en sólidos (Sección 5.1), la técnica es necesariamente sensible a la superficie.
El siguiente diagrama muestra un espectro XPS real obtenido de una muestra de metal Pd usando radiación Mg K α
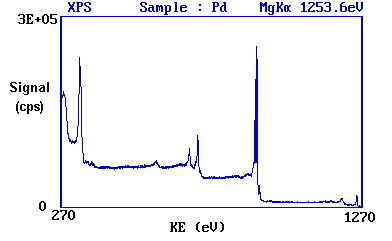
- los picos principales ocurren a energías cinéticas de ca. 330, 690, 720, 910 y 920 eV.
Dado que la energía fotónica de la radiación siempre se conoce, es una materia trivial transformar el espectro para que se grafique contra BE en contraposición a KE.
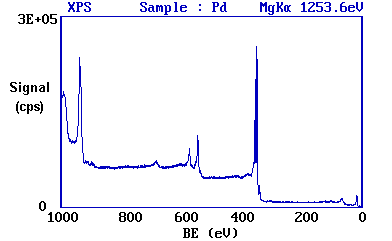
Ahora se ve que el pico más intenso ocurre a una energía de unión de ca. 335 eV
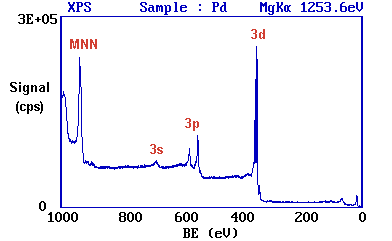
Trabajando hacia abajo desde los niveles de energía más altos...
- la emisión de banda de valencia (4 d, 5 s) ocurre a una energía de unión de ca. 0 - 8 eV (medida con respecto al nivel de Fermi, o alternativamente a ca. 4 - 12 eV si se mide con respecto al nivel de vacío).
- la emisión de los niveles de 4 p y 4 s da lugar a picos muy débiles a 54 eV y 88 eV respectivamente
- el pico más intenso a ca. 335 eV se debe a la emisión de los niveles de 3 d de los átomos de Pd, mientras que los niveles de 3 p y 3 s dan lugar a los picos a ca. 534/561 eV y 673 eV respectivamente.
- ¡el pico restante no es un pico XPS en absoluto! - es un pico de barrena que surge de la emisión de barrena inducida por rayos X. Ocurre a una energía cinética de ca. 330 eV (en este caso no tiene sentido referirse a una energía de unión asociada).
Estas asignaciones se resumen a continuación...
Cabe señalar además que
- existen diferencias significativas en las anchuras naturales de los diversos picos de fotoemisión
- las intensidades de los picos no se relacionan simplemente con la ocupación de electrones de los orbitales
El diagrama opuesto muestra un diagrama de niveles de energía para el sodio con energías de unión aproximadas para los niveles centrales.
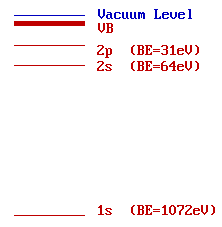
Si estamos utilizando radiación Mg K α (h ν = 1253.6 eV)...
![]() ... ¿a qué energía cinética se observará el pico del fotoelectrón Na 1s?
... ¿a qué energía cinética se observará el pico del fotoelectrón Na 1s?
(el pico de 1 s es el resultante de la fotoionización del nivel 1 s)
![]() ... ¿a qué energía cinética se observarán los picos de fotoelectrones Na 2s y 2p?
... ¿a qué energía cinética se observarán los picos de fotoelectrones Na 2s y 2p?
Dividir espín-órbita
Una inspección más cercana del espectro muestra que la emisión desde algunos niveles (más obviamente 3 p y 3 d) no da lugar a un solo pico de fotoemisión, sino a un doblete estrechamente espaciado. Esto lo podemos ver más claramente si, por ejemplo, ampliamos el espectro en la región de la emisión de 3 d...

De hecho, la fotoemisión de 3 d se divide entre dos picos, uno a 334.9 eV BE y el otro a 340.2 eV BE, con una relación de intensidad de 3:2. Esto surge de los efectos de acoplamiento espín-órbita en el estado final. La configuración electrónica del núcleo interno del estado inicial del Pd es:
(1 s) 2 (2 s) 2 (2 p) 6 (3 s) 2 (3 p) 6 (3 d) 10...
con todas las subconchas completamente llenas.
La eliminación de un electrón de la subcapa de 3 d por fotoionización conduce a una configuración (3 d) 9 para el estado final - ya que los d -orbitales (l = 2) tienen un momento angular orbital distinto de cero, habrá acoplamiento entre el espín desapareado y Momenta angular orbital. El acoplamiento espín-órbita generalmente se trata utilizando uno de dos modelos que corresponden a las dos formas limitantes en las que puede ocurrir el acoplamiento, siendo estas la aproximación del acoplamiento LS (o Russell-Saunders) y la aproximación de acoplamiento j - j. Si consideramos el estado ionizado final del Pd dentro de la aproximación del acoplamiento Russell-Saunders, la configuración (3 d) 9 da lugar a dos estados (ignorando cualquier acoplamiento con niveles de valencia) que difieren ligeramente en energía y en su degeneración...
|
2D 5/2 |
g J = 2x {5/2} +1 = 6 |
|
2D 3/2 |
g J = 2x {3/2} +1 = 4 |
Estos dos estados surgen del acoplamiento de los vectores L = 2 y S = 1/2 para dar valores J permitidos de 3/2 y 5/2. El estado final de energía más baja es el que tiene J máximo (ya que el caparazón está más de medio lleno), es decir, J = 5/2, de ahí que esto da lugar al pico de “menor energía de unión”. Las intensidades relativas de los dos picos reflejan las degeneraciones de los estados finales (g J = 2 J + 1), lo que a su vez determina la probabilidad de transición a dicho estado durante la fotoionización.
La aproximación de acoplamiento Russell-Saunders se aplica mejor solo a los átomos de luz y esta división se puede describir alternativamente usando acoplamiento individual de electrones l - s. En este caso los momentos angulares resultantes surgen del único agujero en la d -shell; un electrón d -shell (o agujero) tiene l = 2 y s = 1/2, lo que nuevamente da valores de j permitidos de 3/2 y 5/2 siendo este último menor en energía.
Los picos en sí se anotan convencionalmente como se indica - tenga en cuenta el uso de letras minúsculas
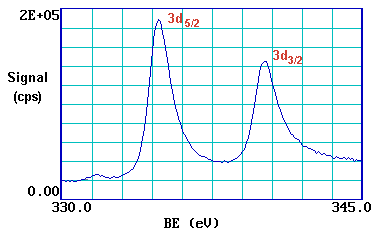
Esta división de espín-órbita, por supuesto, no es evidente con los niveles s (l = 0), sino que se ve con los niveles de núcleo p, d & f que muestran dobletes característicos de espín-órbita.
Turnos Químicos
La energía de unión exacta de un electrón depende no solo del nivel a partir del cual se produce la fotoemisión, sino también del estado de oxidación formal del átomo y del ambiente químico y físico local. Los cambios en cualquiera dan lugar a pequeños cambios en las posiciones de pico en el espectro, los llamados desplazamientos químicos. Tales desplazamientos son fácilmente observables e interpretables en espectros XP (a diferencia de los espectros Auger) porque la técnica es de alta resolución intrínseca (ya que los niveles centrales son discretos y generalmente de una energía bien definida) y es un proceso de un solo electrón (simplificando así la interpretación).
Los átomos de un estado de oxidación positiva superior exhiben una mayor energía de unión debido a la interacción culómbica adicional entre el electrón fotoemitido y el núcleo iónico. Esta capacidad de discriminar entre diferentes estados de oxidación y ambientes químicos es una de las principales fortalezas de la técnica XPS. En la práctica, la capacidad de resolver entre átomos que exhiben desplazamientos químicos ligeramente diferentes está limitada por las anchuras de pico que están gobernadas por una combinación de factores; especialmente
- el ancho intrínseco del nivel inicial y la vida útil del estado final
- el ancho de línea de la radiación incidente, que para las fuentes tradicionales de rayos X solo se puede mejorar mediante el uso de monocromadores de rayos X
- el poder de resolución del analizador de electrón-energía
En la mayoría de los casos, el segundo factor es la mayor contribución al ancho de línea general.
El titanio presenta desplazamientos químicos muy grandes entre los diferentes estados de oxidación del metal; en el diagrama siguiente se compara un espectro de Ti 2p del metal puro (Ti o) con un espectro de dióxido de titanio (Ti 4 +).
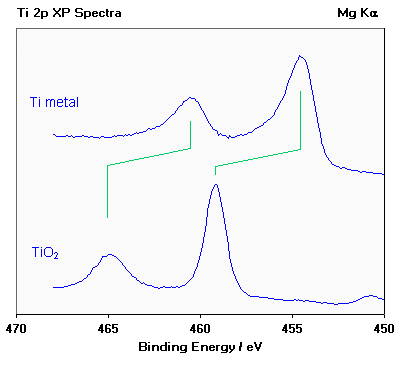 Estados de oxidación del titanio [espectros Ti 2p].
Estados de oxidación del titanio [espectros Ti 2p].
Nota
- los dos componentes de órbita de espín exhiben el mismo desplazamiento químico (∼ 4,6 eV);
- los metales a menudo se caracterizan por una forma de línea asimétrica, con el pico de cola a una mayor energía de unión”, mientras que los óxidos aislantes dan lugar a un perfil de pico más simétrico;
- el pico débil a ca. 450.7 eV en el espectro inferior surge porque las fuentes típicas de rayos X también emiten algunos rayos X de una energía fotónica ligeramente mayor que la línea principal Mg K α; este pico satelital es un “fantasma” del pico principal 2p 3 /2 que surge de la ionización por estas radiografías adicionales.
Estudios dependientes del ángulo
Como se describió anteriormente, el grado de sensibilidad superficial de una técnica basada en electrones tal como XPS puede variarse recogiendo fotoelectrones emitidos en diferentes ángulos de emisión al plano de superficie. Este enfoque puede ser utilizado para realizar análisis no destructivos de la variación de la composición de la superficie con la profundidad (con especificidad del estado químico).

Una serie de espectros fotoelectrónicos Si 2p registrados para ángulos de emisión de 10-90º con respecto al plano superficial. Observe cómo el pico Si 2p del óxido (BE ~ 103 eV) aumenta notablemente en intensidad en los ángulos de emisión de pastoreo, mientras que el pico del silicio elemental subyacente (BE ~ 99 eV) domina el espectro en ángulos de emisión casi normales.
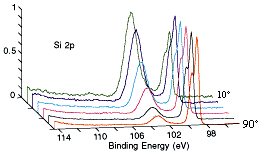
(cortesía de Physical Electronics, Inc. (PHI))
Nota: en este caso el ángulo de emisión se mide con respecto al plano de la superficie (es decir, 90º corresponde a fotoelectrones que salen con una trayectoria normal a la superficie, mientras que 10º corresponde a emisión en un ángulo muy rasante;
Espectroscopia Fotoelectrónica Ultravioleta (UPS)
En UPS la fuente de radiación es normalmente una lámpara de descarga de gas noble; frecuentemente una lámpara de descarga HE que emite He I radiación de energía 21.2 eV. Dicha radiación sólo es capaz de ionizar electrones de los niveles más externos de los átomos, los niveles de valencia. La ventaja de usar dicha radiación UV sobre los rayos X es el ancho de línea muy estrecho de la radiación y el alto flujo de fotones disponibles a partir de fuentes de descarga simples. El énfasis principal del trabajo con UPS ha estado en estudiar:
- la estructura electrónica de sólidos - estudios detallados de ángulo resuelto permiten que la estructura de banda completa se mapee en k -espacio.
- la adsorción de moléculas relativamente simples sobre metales - por comparación de los orbitales moleculares de las especies adsorbidas con los de la molécula aislada y con cálculos.


