8.6: Problemas
- Page ID
- 69822
Problema\(\PageIndex{1}\)
Dada una ecuación genérica de estado\(P = P(V, T, n)\), explica cómo puedes obtener la derivada
\[\frac{\partial V}{\partial T}_{P,n} \nonumber\]
utilizando las propiedades de las derivadas parciales que aprendimos en este capítulo.
Problema\(\PageIndex{2}\)
La ecuación termodinámica:
\[\left (\frac{\partial U}{\partial V} \right )_T=T\left (\frac{\partial P}{\partial T} \right )_V-P \nonumber\]
muestra cómo la energía interna de un sistema varía con el volumen a temperatura constante.
Demostrar que
- \(\left (\frac{\partial U}{\partial V} \right )_T=0\)para un gas ideal.
- \(\left (\frac{\partial U}{\partial V} \right )_T=\frac{a}{V^2}\)por un mol de gas van der Waals (Ecuación\ ref {c2v:eq:vdw})
Problema\(\PageIndex{3}\)
Considera un mol de un gas van der Waals (Ecuación\ ref {c2v:eq:vdw}) y demuestra que
\[\left (\frac{\partial^2 P}{\partial V\partial T}\right )=\left (\frac{\partial^2 P}{\partial T\partial V} \right) \nonumber\]
Problema\(\PageIndex{4}\)
Considera un gas van der Waals (Ecuación\ ref {c2v:eq:vdw}) y demuestra que
\[\left (\frac{\partial V}{\partial T}\right )_{P,n}=\frac{n R}{\left( P-\frac{n^2a}{V^2}+\frac{2n^3ab}{V^3} \right)} \nonumber\]
Pista: Calcular las derivadas que son más fáciles de obtener y utilizar las propiedades de las derivadas parciales para obtener la que el problema pide. No uses la respuesta en tu derivación; obtén la derivada asumiendo que no conoces la respuesta y simplifica tu expresión hasta que se vea como la ecuación anterior.
Problema\(\PageIndex{5}\)
De las definiciones de coeficiente de expansión (\(\alpha\)) y compresibilidad isotérmica (\(\kappa\)):
\[\alpha=\frac{1}{V}\left(\frac{\partial V}{\partial T}\right)_{P,n} \nonumber\]
y
\[\kappa=-\frac{1}{V}\left(\frac{\partial V}{\partial P}\right)_{T,n} \nonumber\]
demostrar que
\[\left(\frac{\partial P}{\partial T}\right)_{V,n}=\frac{\alpha}{\kappa} \nonumber\]
independientemente de la ecuación de estado utilizada.
Nota: Un error común en este problema es asumir una ecuación particular de estado. Utilice la regla de ciclo para encontrar la relación requerida independientemente de cualquier ecuación de estado en particular.
Problema\(\PageIndex{6}\)
Derivar una ecuación similar a la ecuación\ ref {c2v:eq:calculus2v_chain1}, pero que se relaciona
\[\left ( \frac{\partial f}{\partial y} \right )_x \nonumber\]
con
\[\left ( \frac{\partial f}{\partial r} \right )_\theta \nonumber\]
y
\[\left ( \frac{\partial f}{\partial \theta} \right )_r \nonumber\]
Problema\(\PageIndex{7}\)
(Nivel extra de crédito)
La expresión:
\[\nabla^2=\frac{\partial^2}{\partial x^2}+\frac{\partial^2}{\partial y^2} \nonumber\]
es conocido como el operador laplaciano en dos dimensiones.
Cuando se aplica a una función\(f(x,y)\), obtenemos:
\[\nabla^2f(x,y)=\frac{\partial^2f}{\partial x^2}+\frac{\partial^2f}{\partial y^2} \nonumber\]
Expresar\(\nabla^2\) en coordenadas polares (2D) asumiendo el caso especial donde\(r=a\) es una constante.
Problema\(\PageIndex{8}\)
Calcular\(\int_{0}^{1}\int_{1}^{2}\int_{0}^{2}{\left( x^2+yz \right)\, dx\, dy\, dz}.\) Prueba tres órdenes diferentes de integración y verifica que siempre obtienes el mismo resultado.
Problema\(\PageIndex{9}\)
Calcular\(\int_{0}^{2\pi}\int_{0}^{\pi}\int_{0}^{\infty}{e^{-r}r^5\sin{\theta}\, dr\, d\theta\, d\phi}.\) Utilice solo la hoja de fórmulas.
Problema\(\PageIndex{10}\)
¿Cómo se vería Figura\(8.5.2\), reproducida a continuación, para un gas ideal? Esbozar la energía potencial en función de la distancia entre los átomos.
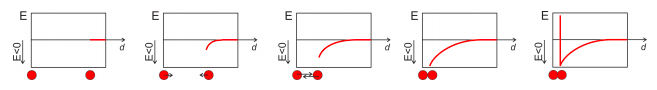
Problema\(\PageIndex{11}\)
De todo lo que aprendimos en este capítulo, y sin hacer ninguna matemática, deberíamos poder calcular el signo (>0, <0 o 0) de las siguientes derivadas:
Para un gas ideal:
\[\left(\frac{\partial U}{\partial T}\right)_{V,n} \nonumber\]
\[\left(\frac{\partial U}{\partial V}\right)_{T,n} \nonumber\]
Para un gas van der Vaals:
\[\left(\frac{\partial U}{\partial T}\right)_{V,n} \nonumber\]
\[\left(\frac{\partial U}{\partial V}\right)_{T,n} \nonumber\]
Asegúrate de que puedes escribir una oración breve explicando tus respuestas.
Problema\(\PageIndex{12}\)
El punto crítico es el estado en el que las fases líquida y gaseosa de una sustancia se vuelven indistinguibles por primera vez. Un gas por encima de la temperatura crítica nunca se condensará en líquido, sin importar cuánta presión se aplique. Matemáticamente, en el punto crítico:
\[\left(\frac{\partial P}{\partial V} \right)_{T,n}=0 \nonumber\]
y
\[ \left(\frac{\partial^2 P}{\partial V^2} \right)_{T,n}=0 \nonumber\]
Obtener las constantes críticas de un gas van der Waals (Ecuación\ ref {c2v:eq:vdw}) en términos de los parámetros\(a\) y\(b\).
Pista: obtener la primera y segunda derivadas de\(P\) con respecto a\(V\), hacerlas iguales a cero, y obtener\(T_c\) y a\(V_c\) partir de estas ecuaciones. Finalmente, reemplace estas expresiones en la Ecuación\ ref {c2v:eq:vdw} para obtener\(P_c\).
Nota
Como se deriva en la Sección 8.3,
\[\label{c2v:eq:calculus2v_chain1} \left(\dfrac{\partial f}{\partial x}\right)_y=\cos{\theta}\left(\dfrac{\partial f}{\partial r}\right)_\theta-\dfrac{\sin{\theta}}{r}\left(\dfrac{\partial f}{\partial \theta}\right)_r\]
Como se define en la Sección 8.5, el Van der Waals se define como:
\[\label{c2v:eq:vdw} P=\frac{nRT}{V-nb}-a \left(\frac{n}{V}\right)^2\]
- Si no estás familiarizado con esto necesitas leer sobre ello antes de seguir adelante

