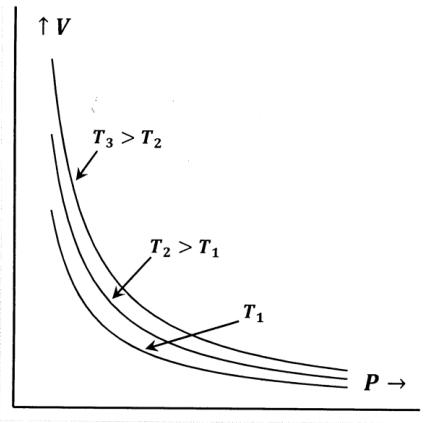
2.1: Ley de Boyle
- Page ID
- 74191
Robert Boyle descubrió la ley de Boyle en 1662. El descubrimiento de Boyle fue que la presión, P, y el volumen, V, de un gas son inversamente proporcionales entre sí si la temperatura, T, se mantiene constante. Podemos imaginar redescubrir la ley de Boyle atrapando una muestra de gas en un tubo y luego midiendo su volumen a medida que cambiamos la presión. Observaríamos un comportamiento así en la Figura 1. Podemos representar este comportamiento matemáticamente como
\[PV={\alpha }^*(n,T)\]
donde reconocemos que la “constante”,\({\alpha }^*\), es en realidad una función de la temperatura y del número de moles,\(n\), de gas en la muestra. Es decir, el producto de presión y volumen es constante para una cantidad fija de gas a una temperatura fija.
Un poco de pensamiento nos convence de que podemos ser más específicos sobre la dependencia de la cantidad de gas. Supongamos que tenemos un volumen de gas a una presión y temperatura fijas, e imaginemos que introducimos una barrera muy delgada que divide el volumen en mitades exactamente iguales, sin cambiar nada más. En este caso, la presión y temperatura del gas en cada uno de los nuevos contenedores serán las mismas que originalmente eran. Pero el volumen es la mitad de grande, y el número de moles en cada uno de los contenedores de tamaño medio también debe ser la mitad del número original. Es decir, el producto presión-volumen debe ser directamente proporcional al número de moles de gas en la muestra:
\[PV=n\alpha (T)\]
donde ahora\(\alpha (T)\) es una función solo de la temperatura. Cuando repetimos este experimento usando diferentes sustancias gaseosas, descubrimos otro hecho notable: No solo todos obedecen la ley de Boyle, sino que también el valor de\(\alpha (T)\) es el mismo para cualquier gas.