2.2: Ley de Carlos
- Page ID
- 74209
Los experimentos cuantitativos que establecen la ley fueron publicados por primera vez en 1802 por Gay-Lussac, quien acreditó a Jacques Charles por haber descubierto la ley antes. La ley de Charles relaciona el volumen y la temperatura de un gas cuando las mediciones se realizan a presión constante. Podemos imaginar redescubrir la ley de Charles atrapando una muestra de gas en un tubo y midiendo su volumen a medida que cambiamos la temperatura, manteniendo la presión constante. Esto supone que tenemos una manera de medir la temperatura, tal vez definiéndola en términos del volumen de una cantidad fija de algún otro líquido, como el mercurio líquido. A una presión fija,\(P_1\), observamos una relación lineal entre el volumen de una muestra de gas y su temperatura, como la de la Figura 2. Si repetimos este experimento con la misma muestra de gas a mayor presión\(P_2\),, observamos una segunda relación lineal entre el volumen y la temperatura del gas. Si extendemos estas líneas hasta su intersección con el eje de temperatura a volumen cero, hacemos otro descubrimiento importante: Ambas líneas se cruzan con el eje de temperatura en un mismo punto.
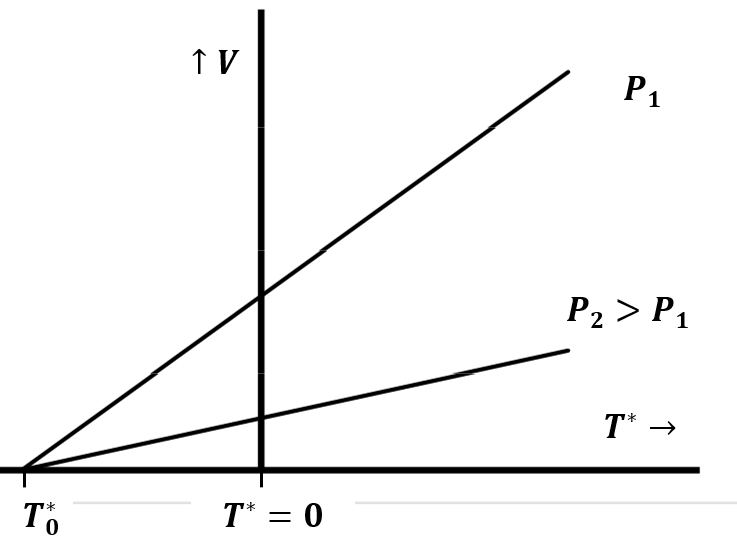
Podemos representar este comportamiento matemáticamente como
\[V={\beta }^*\left(n,P\right)T^*+{\gamma }^*(n,P)\]
donde reconocemos que tanto la pendiente como la intersección del eje V de la gráfica dependen de la presión del gas y del número de moles de gas en la muestra. Una pequeña reflexión muestra que aquí también la pendiente e intercepción deben ser directamente proporcionales al número de moles de gas, para que podamos reescribir nuestra ecuación como
\[V=n\beta \left(P\right)T^*+n\gamma (P)\]
Cuando repetimos estos experimentos con diferentes sustancias gaseosas, descubrimos un dato adicional importante:\(\beta (P)\) y\(\gamma (P)\) son los mismos para cualquier gas. Esto significa que la temperatura a la que el volumen se extrapola a cero es la misma para cualquier gas y es independiente de la presión constante que mantenemos ya que variamos la temperatura (Figura 2).


