4.12: La frecuencia de colisiones entre moléculas de gas diferentes
- Page ID
- 74500
Hasta ahora en nuestro desarrollo teórico de las propiedades de los gases, hemos asumido que las moléculas de gas ideales son masas puntuales. Si bien pueden chocar con las paredes de su contenedor, las masas puntuales no pueden chocar entre sí. Como vimos en nuestra discusión sobre la ecuación de van der Waals, la desviación de los gases reales del comportamiento ideal del gas es una indicación de que una molécula de gas individual ocupa un volumen finito.
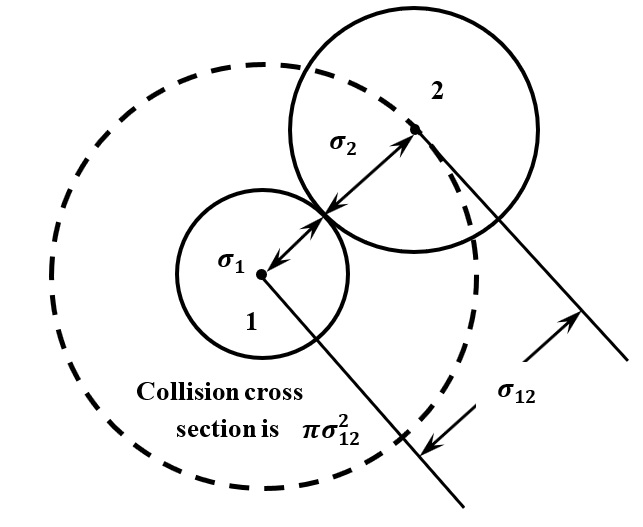
Para desarrollar un modelo de colisiones moleculares, necesitamos conocer el tamaño y la forma de las moléculas colisionantes. Para un modelo general, queremos utilizar el tamaño y la forma más simples posibles. En consecuencia, consideramos un modelo en el que las moléculas de gas son esferas con radios bien definidos. Dejamos que los radios de las moléculas\(1\) y\(2\) sean\(\sigma_1\) y\(\sigma_2\), respectivamente. Ver Figura 10. Cuando tales moléculas chocan, sus superficies deben entrar en contacto, y la distancia entre sus centros debe ser\(\sigma_{12}=\sigma_1+\sigma_2\). Llamamos\(\sigma_{12}\) al radio de colisión.
Consideremos una molécula de tipo\(1\) en un contenedor con un gran número de moléculas de tipo\(2\). Suponemos que hay\(N_2\) moléculas de tipo\(2\) por unidad de volumen. Cada molécula de tipo\(2\) tiene cierta velocidad,\(v_{12}\), relativa a la molécula de tipo\(1\). A partir de nuestro desarrollo anterior, conocemos tanto la función de densidad de\(v_{12}\) probabilidad como el valor esperado\(\left\langle v_{12}\right\rangle\). \(1\)Tanto la molécula como todas las moléculas de tipo\(2\) se mueven con velocidades continuamente variables. Sin embargo, es razonable suponer que, en promedio, los encuentros entre molécula\(1\) y moléculas de tipo\(2\) son los mismos que serían si todas las\(2\) moléculas de tipo se fijaran en ubicaciones aleatorias en el volumen, y la molécula\(1\) se moviera entre ellas con una velocidad igual a la velocidad relativa promedio,\(\left\langle v_{12}\right\rangle\).
Bajo este supuesto, una molécula 1 recorre una distancia igual a\(\left\langle v_{12}\right\rangle\) en unidad de tiempo. Al hacerlo, choca con cualquier tipo de\(2\) molécula cuyo centro se encuentre a una distancia\(\sigma_{12}\) de su propio centro. Por el momento, supongamos que la trayectoria de la molécula no\(1\) se ve afectada por las colisiones que experimenta. Entonces, en unidad de tiempo, la molécula\(1\) barre un cilindro cuya longitud es\(\left\langle v_{12}\right\rangle\) y cuya área de sección transversal es\(\pi \sigma^2_{12}\). El volumen de este cilindro es\(\pi \sigma^2_{12}\left\langle v_{12}\right\rangle\). (Ver Figura 11.)
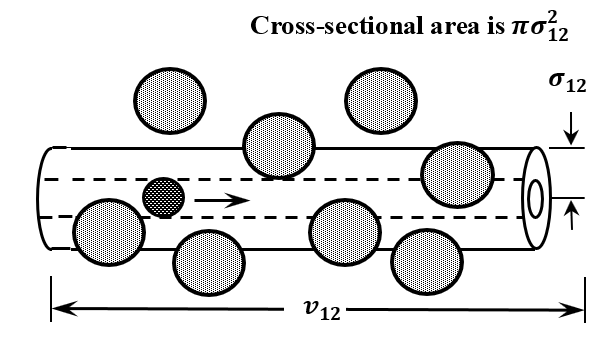
Dado que hay\(N_2\) moléculas de tipo\(2\) por unidad de volumen, el número de\(2\) moléculas tipo en el cilindro es\(N_2\pi \sigma^2_{12}\left\langle v_{12}\right\rangle\). Cada una de estas moléculas es una molécula de tipo\(2\) que experimenta una colisión con la molécula\(1\) en unidad de tiempo. Dejando\({\widetilde{\nu }}_{12}\) ser la frecuencia (número de colisiones por unidad de tiempo) con la que la molécula\(1\) colisiona con moléculas de tipo\(2\), tenemos
\[{\widetilde{\nu }}_{12}=N_2\pi \sigma^2_{12}\left\langle v_{12}\right\rangle =N_2\pi \sigma^2_{12}{\left(\frac{8kT}{\pi \mu }\right)}^{1/2}\]
\[=N_2\sigma^2_{12}{\left(\frac{8\pi kT}{\mu }\right)}^{1/2}\]
Dos parámetros adicionales que son útiles para caracterizar colisiones moleculares son\({\tau }_{12}\), el tiempo medio entre colisiones y\({\lambda }_{12}\), la distancia media esa molécula\(1\) viaja entre colisiones con moléculas sucesivas de tipo\(2\). \({\lambda }_{12}\)se llama el camino libre medio. El tiempo medio entre colisiones es simplemente el recíproco de la frecuencia de colisión,
\[{\tau }_{12}={1}/{\widetilde{\nu }_{12}}\]
y el camino libre medio para la molécula\(1\) es la distancia que\(1\) realmente recorre esa molécula en este tiempo, que es\(\left\langle v_1\right\rangle\), no\(\left\langle v_{12}\right\rangle\), para que
\[{\lambda }_{12}=\left\langle v_1\right\rangle {\tau }_{12}=\frac{\left({\mu }/{m}\right)^{1/2}}{N_2\pi \sigma^2_{12}}\]
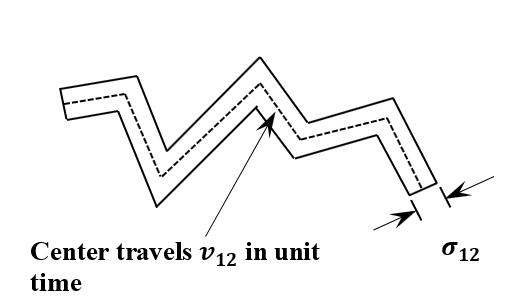
Ahora, necesitamos reevaluar el supuesto de que la trayectoria de una molécula de una molécula no\(1\) se ve afectada por sus colisiones con moléculas de tipo\(2\). Claramente, este no es el caso. El camino de la molécula\(1\) cambia abruptamente en cada colisión. El cilindro real que\(1\) barre la molécula tendrá numerosos torceduras, como se indica en la Figura 12. El cilindro torcido se puede producir a partir de uno recto haciendo una serie de cortes oblicuos (uno para cada torcedura) a través del cilindro recto y luego girando los extremos de cada corte en convergencia. Si pensamos en el cilindro como una varilla sólida, su volumen no cambia por estos cortes y rotaciones. El volumen del cilindro torcido es el mismo que el del cilindro recto. Así, nuestras conclusiones sobre la frecuencia de colisión, el tiempo medio entre colisiones y la trayectoria libre media no se ven afectadas por el hecho de que la trayectoria de la molécula\(1\) cambia en cada colisión.