6.3: Equilibrio y Reversibilidad - Equilibrios de Fase
- Page ID
- 74412
Para revisar las características generales de los equilibrios de fase, consideremos un sistema familiar. Supongamos que tenemos un cilindro transparente pero muy fuerte, sellado con un pistón sin fricción, dentro del cual hemos atrapado una cantidad de agua líquida pura a alguna alta presión. Podemos fijar la presión del agua líquida en cualquier valor que elijamos aplicando una fuerza apropiada al pistón. Supongamos que mantenemos la temperatura constante y forzamos el volumen a aumentar retirando el pistón en incrementos muy pequeños. Debido a que el agua pura no se comprime fácilmente, encontramos inicialmente que la presión del agua disminuye y lo hace en incrementos muy grandes.
Sin embargo, después de un pequeño aumento en el volumen, encontramos que imponer un aumento de volumen adicional cambia el comportamiento del sistema abruptamente. El sistema sufre un cambio profundo. Lo que antes era líquido puro se convierte en una mezcla de líquido y gas. A medida que imponemos aún más aumentos de volumen, la presión del sistema permanece constante, el líquido adicional pasa de la fase líquida a la fase gaseosa, y encontramos que debemos suministrar cantidades sustanciales de calor para mantener constante la temperatura del sistema. Si seguimos forzando aumentos de volumen de esta manera, la vaporización continúa hasta que todo el líquido se evapore.
Si imponemos una disminución en el volumen del sistema bifásico, vemos el proceso inverso. La presión del sistema permanece constante, parte del gas se condensa en líquido y el sistema cede calor a los alrededores. Para cualquier temperatura dada, estas conversiones se equilibran con precisión a alguna presión particular, y estas condiciones caracterizan un estado de equilibrio líquido-vapor. A cualquier presión dada, la temperatura de equilibrio se denomina punto de ebullición del líquido. La presión y temperatura de equilibrio especifican completamente el estado del sistema, a excepción de las cantidades exactas de agua líquida y gaseosa presentes.
Si comenzamos con este sistema en un estado de equilibrio líquido-vapor, podemos aumentar la cantidad de vapor imponiendo un pequeño aumento de volumen. Por el contrario, podemos disminuir la cantidad de vapor imponiendo una disminución de volumen muy pequeña. A la temperatura y presión de equilibrio, cambiar el volumen impuesto en una cantidad arbitrariamente pequeña (de\(V\) a\(V\pm dV\)) es suficiente para invertir la dirección del cambio que se produce en el sistema. Llamamos a cualquier proceso cuya dirección pueda ser revertida por un cambio arbitrariamente pequeño en una función de estado termodinámico un proceso reversible. Evidentemente, existe una estrecha conexión entre los procesos reversibles y los estados de equilibrio. Si un proceso va a ocurrir de manera reversible, el sistema debe pasar continuamente de un estado de equilibrio a otro.
En esta descripción, la vaporización reversible a temperatura constante del agua es impulsada por cambios de volumen arbitrariamente pequeños. El sistema responde a estos cambios de volumen impuestos para mantener una presión de vapor de equilibrio constante a la temperatura especificada. Decimos que el proceso reversible “se lleva a cabo a presión y temperatura constantes”. También podemos describir este proceso como impulsado por cambios arbitrariamente pequeños en la presión aplicada: Si la presión aplicada excede la presión de vapor de equilibrio en un incremento arbitrariamente pequeño,\(dP>0\), se produce condensación; si la presión aplicada es menor que la presión de vapor de equilibrio por un arbitrariamente pequeño incremento,\(dP<0\), se produce la vaporización. Para describirlo tersamente, introducimos una figura del habla y decimos que el proceso reversible ocurre “mientras que la presión del sistema y la presión aplicada son iguales”. Literalmente, por supuesto, no puede haber ningún cambio cuando estas presiones son iguales.
Para hacer que el agua se vaporice a una temperatura y presión constantes, debemos agregar energía térmica al sistema. Este calor se denomina calor latente de vaporización o entalpía de vaporización, y debe ser suministrado desde alguna entidad en los alrededores. Cuando el vapor de agua se condensa, este calor latente debe ser retirado del sistema y tomado por los alrededores. (El cambio de entalpía para vaporizar un mol de una sustancia generalmente se denota\({\Delta }_{vap}H\). Varía con la temperatura y la presión. Las tablas suelen dar valores experimentales de la temperatura de ebullición en equilibrio a una presión de 1 bar o 1 atm; luego dan la entalpía de vaporización a esta temperatura y presión. Se discute la función de entalpía en el Capítulo 8.)
Cuatro condiciones son suficientes para especificar exactamente el estado inicial o final: el número de moles de líquido, el número de moles de gas, la presión y la temperatura. El cambio es una conversión de algún líquido a gas, o viceversa. Podemos representar este cambio como una transición de un estado inicial a un estado final donde\(n^o_{liquid}\) y\(n^o_{gas}\) son los números iniciales de moles de líquido y gas, respectivamente, y\(\delta n\) es el número incremental de moles vaporizados:\[\left(P,\ T,n^o_{liquid},n^o_{gas}\right)\to \left(P,\ T,n^o_{liquid}-\delta n,n^o_{gas}+\delta n\right)\]
La presión inicial y la temperatura son las mismas que la presión y temperatura finales. Efectuar este cambio requiere que se agregue una cantidad de calor\(\left({\Delta }_{vap}H\right)\delta n\),, al sistema, sin cambiar la temperatura del sistema.
Esto introduce otro requisito que debe satisfacer un proceso reversible. Si el agua que se vaporiza reversiblemente va a tomar una cantidad de calor arbitrariamente pequeña, el sistema debe estar en contacto con los alrededores que estén más calientes que el sistema. La diferencia de temperatura entre el sistema y su entorno debe ser arbitrariamente pequeña, ya que podemos describir exactamente el mismo proceso como ser impulsado por el contacto del sistema, a temperatura\(T\), con el entorno a temperatura\(\hat{T}+\delta \hat{T}\). Si mantenemos la presión aplicada constante a la presión de vapor de\(T\) equilibrio de temperatura, el volumen del sistema aumenta. Podemos invertir la dirección del cambio cambiando la temperatura de los alrededores de\(\hat{T}+\delta \hat{T}\) a\(\hat{T}-\delta \hat{T}\). Si el proceso es para satisfacer nuestro criterio de reversibilidad, la diferencia entre estas dos temperaturas debe ser arbitrariamente pequeña. Para describir este requisito de manera tersa, nuevamente introducimos una figura del habla y decimos que el proceso reversible ocurre “mientras la temperatura del sistema y la temperatura del entorno son iguales”.
Si repetimos el experimento de agua en cilindro con la temperatura mantenida constante en un valor ligeramente diferente, obtenemos resultados similares. De nuevo hay una presión a la que el proceso de conversión de líquido en vapor está en equilibrio. A esta temperatura y presión, tanto el agua líquida como la gaseosa pueden estar presentes en el sistema, y, en tanto no se añada o se elimine calor del sistema, la cantidad de cada uno permanece constante. Cuando mantenemos constante la presión del sistema en el valor de equilibrio y suministramos una cantidad de calor al sistema, una cantidad de líquido se convierte nuevamente en agua gaseosa. (La cantidad de calor requerida para convertir un mol de líquido en agua gaseosa, los equilibrios de fases son ligeramente diferentes de la cantidad requerida en el experimento anterior. Esto es a lo que nos referimos cuando decimos que la entalpía de vaporización varía con la temperatura.)
Este experimento se puede repetir para muchas temperaturas. Siempre y cuando la temperatura esté en el rango\ (\ mathrm {273.16}
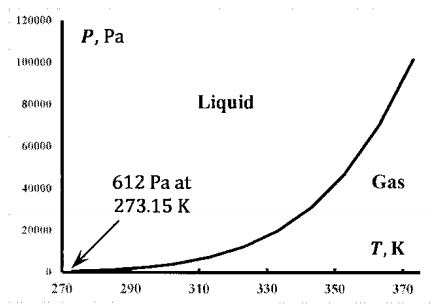
A continuación\(273.16\ \mathrm{K}\), no puede existir un sistema de equilibrio que contenga solo agua líquida y gaseosa. A altas presiones, un sistema de equilibrio bifásico contiene sólidos y líquidos; a presiones suficientemente bajas, contiene sólido y gas. Arriba\(647.1\ \mathrm{K}\), la distinción entre agua líquida y gaseosa se desvanece. El agua existe como una sola fase densa. Esta es la temperatura crítica. Por encima de la temperatura crítica, hay una sola fase fluida a cualquier presión.
Si mantenemos la presión constante y eliminamos el calor de una cantidad de agua líquida, la temperatura disminuye hasta llegar finalmente a una temperatura a la que el agua comienza a congelarse. En este punto, el agua y el hielo están en equilibrio. La eliminación adicional del calor no disminuye la temperatura del sistema agua-hielo; más bien, la temperatura permanece constante y el agua adicional se congela en hielo. Solo cuando todo el líquido se ha congelado, la eliminación adicional del calor causa una disminución adicional en la temperatura del sistema. Cuando repetimos este experimento a una serie de temperaturas, encontramos una línea continua de presión, puntos de temperatura que son puntos de equilibrio líquido-hielo.
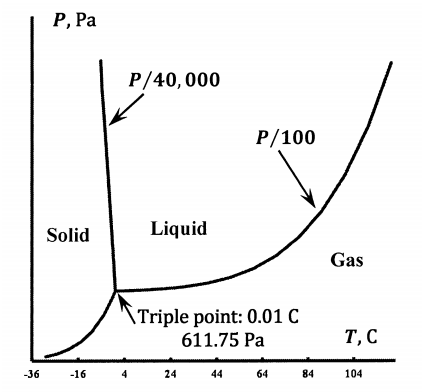
Como se esboza en la Figura 4, la línea de equilibrio líquido-hielo cruza la línea de equilibrio líquido-vapor. En esta intersección, el agua líquida, el hielo y el vapor de agua están todos en equilibrio entre sí. Sólo hay uno de esos puntos. Se le llama el punto triple del agua. El punto de hielo o punto de fusión del agua es la temperatura a la que el agua sólida y líquida están en equilibrio a una atmósfera en presencia de aire. El agua contiene aire disuelto. El triple punto ocurre en un sistema de agua pura; es la temperatura y presión a la que el agua gaseosa, líquida y sólida están en equilibrio. Por definición, la temperatura del punto triple es 273.16 K. Experimentalmente, la presión en el punto triple es 611 Pa. Experimentalmente, el punto de fusión es 273.15 K.
Para congelar un líquido, debemos quitar el calor. Para fundir (fundir) la misma cantidad del sólido a la misma temperatura y presión, debemos agregar la misma cantidad de calor. Este calor se llama el calor latente de fusión o la entalpía de fusión. Generalmente se denota la entalpía de fusión para un mol de una sustancia\({\Delta }_{fus}H\). Varía ligeramente con la temperatura y la presión. Las tablas suelen dar valores experimentales de la temperatura de fusión en equilibrio a una presión de 1 bar o 1 atm; luego dan la entalpía de fusión a esta temperatura y presión.
A bajas presiones y temperaturas, el hielo está en equilibrio con el agua gaseosa. Una línea continua de puntos de presión-temperatura representa las condiciones bajo las cuales el sistema contiene solo hielo y vapor de agua. A medida que aumenta la temperatura, la línea de equilibrio hielo-vapor termina en el punto triple. La conversión de un sólido directamente en su vapor se llama sublimación. Para sublimar un sólido a su vapor requiere la adición de calor. Este calor se llama el calor latente de la sublimación o la entalpía de la sublimación. Generalmente se denota la entalpía de sublimación para un mol de una sustancia\({\Delta }_{sub}H\). Varía ligeramente con la temperatura y la presión.


