6.5: Equilibrios en reacciones químicas
- Page ID
- 74394
Los equilibrios que involucran reacciones químicas comparten características importantes con los equilibrios de fase y distribución. En el Capítulo 5, desarrollamos la expresión constante de equilibrio a partir de ideas sobre las velocidades de reacción. Para la presente comparación, consideremos el equilibrio entre los gases dióxido de nitrógeno\(NO_2\), y el tetroxido de dinitrógeno,\(N_2O_4\):
\[\ce{N_2O_4\ (g) <=> 2NO_2 (g)}\]
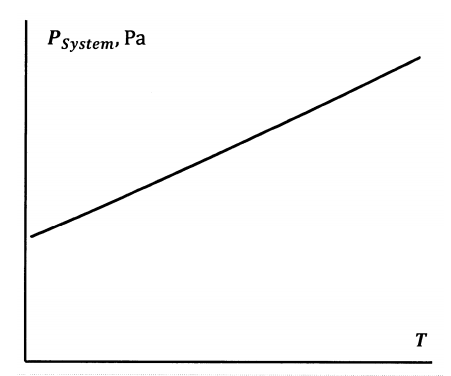
Supongamos que atrapamos una cantidad de puro\(N_2O_4\) en un cilindro cerrado con un pistón. Si fijamos la temperatura y el volumen de este sistema, la reacción de disociación se produce hasta lograr el equilibrio a alguna presión del sistema. Para los propósitos actuales, supongamos que ambos\(N_2O_4\) y\(NO_2\) comportarse como gases ideales. La presión del sistema de equilibrio será igual a la suma de las presiones parciales:\(P=P_{N_2O_4}+P_{NO_2}\). Si ahora hacemos una serie de experimentos, en los que mantenemos el volumen constante mientras permitimos que la temperatura cambie, encontramos una serie continua de combinaciones presión-temperatura en las que el sistema está en equilibrio. Esta curva se esboza en la Figura 5. Es muy similar a la curva que describe la dependencia del equilibrio agua-vapor de agua sobre la presión y la temperatura.
Si mantenemos la temperatura constante y permitimos que el volumen varíe, podemos cambiar la fuerza sobre el pistón para mantener constante la presión total en un nuevo valor,\(P^*_{total}\). La posición del equilibrio químico cambiará. En la nueva posición de equilibrio, las presiones nuevas\(N_2O_4\) y\(NO_2\) parciales satisfarán la relación de presión total. Cuando repetimos este experimento, encontramos que, sea cual sea la presión total, las presiones parciales de equilibrio están relacionadas entre sí como se esboza en la Figura 6.
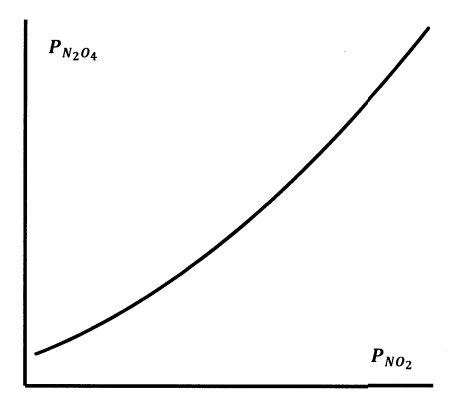
Encontramos que los datos experimentales se ajustan a la ecuación
\[K_P= \dfrac{P^2_{NO_2}}{P_{N_2O_4}},\]
donde\(K_P\) está la constante de equilibrio para la reacción. (La presión es una medida de la concentración de gas. Posteriormente, vemos que la constante de equilibrio se puede expresar más rigurosamente como una proporción de fugacidades—o actividades.)


