11.1: Capacidad calorífica en función de la temperatura
- Page ID
- 73880
Es relativamente fácil medir las capacidades de calor en función de la temperatura. Si medimos la capacidad calorífica de presión constante de una sustancia pura en un amplio rango de temperatura, normalmente observamos una curva como la de la Figura 1. La capacidad calorífica es una función suave y continua de la temperatura excepto por un pequeño número de discontinuidades. Estos ocurren a temperaturas donde la sustancia sufre cambios de fase. Estos pueden ser cambios de una fase sólida a otra, fundir para convertir una fase sólida en líquido, o vaporización para convertir el líquido en gas. Los detalles de la curva dependen de la presión; por ejemplo, a baja presión, podemos observar la sublimación del material de una fase sólida directamente a su fase gaseosa.
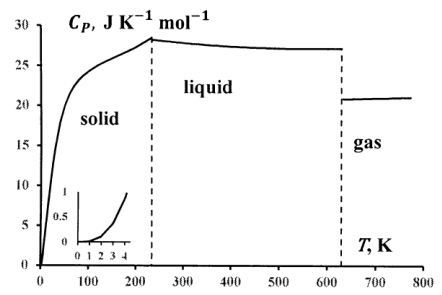
Otra característica general de estas curvas es que la capacidad calorífica de la sustancia sólida disminuye a cero a medida que la temperatura absoluta disminuye a cero; la curva se encuentra con la abscisa en el cero de temperatura y lo hace asintóticamente. Que esto sea cierto para todas las sustancias parece una extraña suerte de coincidencia. ¿Por qué todas las sustancias sólidas deberían exhibir esencialmente la misma capacidad calorífica (cero) a una temperatura (cero absoluto)?
Resulta que este resultado tiene una interpretación molecular sencilla en la teoría de la termodinámica estadística. En la Sección 22.6, consideramos una teoría de la capacidad calorífica a baja temperatura desarrollada por Einstein. La teoría de Einstein explica todas las características cualitativas que se observan cuando medimos las capacidades térmicas a bajas temperaturas, pero sus predicciones no son cuantitativamente exactas. Debye extendió el modelo de Einstein y desarrolló una teoría que da generalmente excelentes predicciones cuantitativas. La teoría de Debye predice que, a temperaturas cercanas al cero absoluto, la capacidad calorífica varía según el cubo de temperatura:\(C_P=AT^3\), donde\(A\) es una constante. Si tenemos datos de capacidad calorífica hasta una temperatura cercana al cero absoluto, podemos estimar el valor de\(A\) a partir del valor de\(C_P\) a la temperatura más baja disponible.
Anticipando los resultados que desarrollamos en el Capítulo 22, podemos caracterizar la interpretación estadística de la siguiente manera: Cuando un sistema de moléculas cede calor a su entorno, algunas de las moléculas pasan de niveles de energía más altos a niveles más bajos. La termodinámica estadística postula que la fracción de las moléculas que se encuentran en el nivel de energía más bajo se acerca a una a medida que la temperatura va a cero. Si casi todas las moléculas ya están en el nivel de energía más bajo, disminuir la temperatura aún más tiene un efecto insignificante sobre la energía y entalpía del sistema.
Dados estos datos de capacidad calorífica, podemos encontrar el cambio de entalpía o entropía que se produce a medida que cambiamos la temperatura de una cantidad de la sustancia de alguna temperatura de referencia a cualquier otro valor. Cuando utilizamos la presión y la temperatura como variables independientes, tenemos
\[dH=C_PdT+\left[V-T{\left(\frac{\partial V}{\partial T}\right)}_P\right]dP\]
y
\[dS=\frac{C_P}{T}dT-{\left(\frac{\partial V}{\partial T}\right)}_PdP\]
A presión constante, tenemos
\[\left(dH\right)_P=C_PdT\]
para que
\[H\left(T\right)-H\left(T_{ref}\right)=\int^T_{T_{ref}}{C_PdT}\]
y
\[{\left(dS\right)}_P=\frac{C_P}{T}dT\]para que\[S\left(T\right)-S\left(T_{ref}\right)=\int^T_{T_{ref}}{\frac{C_P}{T}dT}\]
Si se producen transiciones de fase a medida que la temperatura va de la temperatura de referencia a la temperatura de interés, estas integraciones deben realizarse en etapas. Además, debemos incluir los cambios de entalpía y entropía que ocurren durante estos cambios de fase.


