11.11: La fugacidad y la energía libre de Gibbs de una sustancia en cualquier sistema
- Page ID
- 73826
Podemos encontrar la energía libre de formación de Gibbs para sustancias cuyos estados estándar son fases condensadas. Como se indica en la Sección 11.9, adoptamos la misma regla para cualquier sustancia; fijamos\(G^o_A={\Delta }_fG^o\left(A\right)\) para cualquier sustancia, ya sea que su estado estándar sea un gas, líquido o sólido. La energía libre de Gibbs de los elementos se convierte en el “punto cero” para la energía libre de Gibbs de cualquier sustancia.
En los Capítulos 14 y 15, vemos que también podemos definir la fugacidad de cualquier sustancia en cualquier sistema; es decir, podemos definir la fugacidad para un líquido puro, un sólido puro, o para un componente en cualquier mezcla. Cuando lo hacemos, la energía libre de Gibbs de un mol de la sustancia en el sistema,\({\overline{G}}_A\left(\mathrm{system},P\right)\), viene dada por la misma relación que desarrollamos para el molar Gibbs energía libre de un gas puro. ENCONTRAMOS
\[{\overline{G}}_A\left(\mathrm{system},P\right)={\Delta }_fG^o_A\left({HIG}^o\right)+RT{ \ln \left(\frac{f_A\left(\mathrm{system},P\right)}{f_A\left({HIG}^o\right)}\right)\ }\]
Para obtener este resultado y ver cómo encontrar la fugacidad de\(A\) en cualquier sistema,\(f_A\left(\mathrm{system},P\right)\), debemos introducir una serie de ideas adicionales. Por ahora, tomemos nota de algunas de las consecuencias.
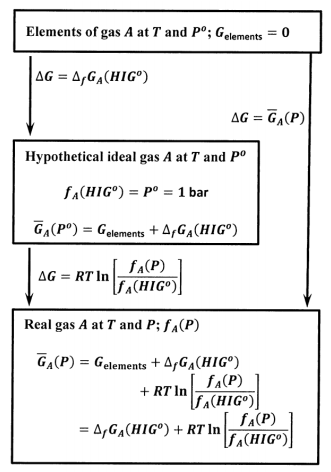
La consecuencia esencial es que la diferencia entre la energía libre de Gibbs de un mol de una sustancia en dos sistemas diferentes, digamos el sistema X y el sistema Y, se puede expresar utilizando la relación de las fugacidades correspondientes. Es decir,
\[{\overline{G}}_A\left(\mathrm{system}\mathrm{\ \ X},P_X\right)-{\overline{G}}_A\left(\mathrm{system}\mathrm{\ \ Y},P_Y\right)=RT{ \ln \left(\frac{f_A\left(\mathrm{system},P_X\right)}{f_A\left(\mathrm{system}\mathrm{\ \ Y},P_Y\right)}\right)\ }\]
donde\(P_X\) y\(P_Y\) son las presiones de los sistemas X e Y, respectivamente, y ambos sistemas están a la misma temperatura.
Para líquidos y sólidos, el estado estándar es la sustancia pura en su forma más estable a una barra y la temperatura de interés. La fugacidad en el estado estándar debe determinarse experimentalmente. Si el líquido o sólido tiene una presión de vapor insignificante, esto puede no ser posible. Dado que pretendemos que “cualquier sistema” incluya todo tipo de mezclas y soluciones, puede ser muy difícil encontrar el cambio de energía libre de Gibbs para llevar la sustancia de su estado estándar al sistema arbitrario en el que se encuentra su fugacidad\(f_A\left(\mathrm{system},P\right)\). En el Capítulo 14, se introduce la actividad química de la sustancia para hacer frente a tales casos.
Cuando definimos la actividad química de una sustancia en un sistema particular, también introducimos un nuevo estado estándar. El criterio principal para nuestra elección de este estado estándar de actividad es que podamos medir cuánto difiere la energía libre de Gibbs de la sustancia entre el estado estándar de actividad y otros estados del sistema. Un objetivo principal de los siguientes siete capítulos es introducir ideas para medir la diferencia entre la energía libre de Gibbs de una sustancia en dos estados de un sistema dado. Aun así, nuestro tratamiento de los temas involucrados en este paso es bastante incompleto.


