12.4: Medición del Cambio de Entropía para Cualquier Proceso Reversible
- Page ID
- 74438
Definimos la entropía en términos de su diferencial como
\[dS=dq^{rev}/T.\]
Para medir un cambio de entropía usando esta definición se requiere que el proceso sea reversible, lo que significa que el sistema y el entorno deben estar a la misma temperatura que ocurre la transferencia de calor. Entendemos que la transferencia de calor reversible es el caso limitante en el que la diferencia de temperatura entre el sistema y el entorno se vuelve arbitrariamente pequeña. Aquí queremos considerar los problemas conceptuales asociados a mantener la temperatura del entorno arbitrariamente cercana a la temperatura del sistema mientras que el sistema sufre un cambio reversible arbitrario, que puede incluir un cambio de temperatura.
Podemos iluminar un aspecto necesario planteando un dilema trivial: Dado que el sistema y el entorno comprenden conjuntamente el universo, el requisito de que el sistema y el entorno estén a la misma temperatura podría parecer requerir que todo el universo esté a una sola temperatura. Es evidente que esta condición no se cumple; la temperatura del universo varía de un lugar a otro. De hecho, el requisito es sólo que el sistema y esa porción del entorno con la que el sistema intercambia calor estén a la misma temperatura. Podemos satisfacer este requisito permitiendo el intercambio de calor entre el sistema y una porción del entorno, bajo condiciones en las que la combinación de los dos se aísla térmicamente del resto del universo.
El aspecto no trivial de este problema surge del requisito de que la temperatura del entorno permanezca arbitrariamente cercana a la temperatura del sistema, mientras que ambas temperaturas cambian y se intercambia calor entre el sistema y el entorno. Una solución torpe a este problema es suponer que cambiamos un conjunto de entornos (a temperatura\(T\)) por un nuevo conjunto (a temperatura\(T+\Delta T\)) siempre que la temperatura del sistema cambie por\(\Delta T\). Una solución más elegante es utilizar una máquina que pueda medir el cambio de entropía asociado a un cambio reversible arbitrario en cualquier sistema cerrado. Se trata de un dispositivo conceptual, no de una máquina práctica. Podemos usarlo en experimentos gedanken para realizar arbitrariamente pequeños cambios en la temperatura y presión del sistema a lo largo de cualquier camino reversible. En cada paso de este camino, el cambio de entropía es
\[dS=\frac{1}{T}{\left(\frac{\partial H}{\partial T}\right)}_PdT-{\left(\frac{\partial V}{\partial T}\right)}_PdP\]
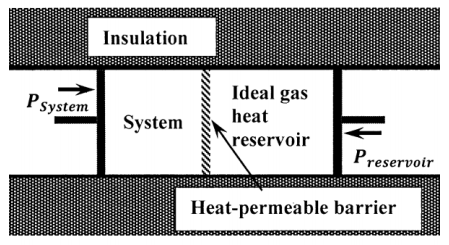
La máquina de medición de entropía se esboza en la Figura 1. En este dispositivo, la porción del entorno con la que el sistema puede intercambiar calor es una cantidad de gas ideal, que funciona como reservorio de calor. Este depósito de calor está en contacto térmico con el sistema. La combinación de sistema y reservorio de calor de gas ideal se aísla térmicamente del resto del universo. Consideramos el caso en el que solo se puede hacer trabajo de presión-volumen en el sistema o en el depósito de calor de gas ideal. En este dispositivo, todos los cambios son impulsados por cambios en las presiones aplicadas al entorno (el reservorio de calor de gas ideal) y el sistema. La presión aplicada al sistema y la presión aplicada al depósito de calor de gas ideal se pueden variar independientemente. Suponemos que el sistema está inicialmente en equilibrio y que los cambios en las presiones aplicadas se efectúan de tal manera que todos los cambios en el sistema y en el reservorio de calor de gas ideal ocurren de manera reversible. Para cualquier cambio efectuado en la máquina de medición de entropía, los cambios de calor y entropía en el depósito de calor son\(\hat{q}\) y\(\Delta \hat{S}\).
Proceso isotérmico
Consideremos primero un proceso en el que se debe transferir una cantidad de calor del entorno al sistema mientras ambos se encuentran a temperatura constante\(T_P\). Para ser específicos, que este sea un proceso en el que un mol de líquido puro se vaporiza a presión constante, absorbiendo una cantidad de calor igual a la entalpía molar de vaporización. Podemos suministrar este calor comprimiendo reversible e isotérmicamente el depósito de calor de gas ideal. Para mantener constante la temperatura del depósito de calor de gas ideal, retiramos reversiblemente el pistón que controla la presión del sistema, provocando la vaporización del líquido en el sistema y la absorción por el sistema del calor cedido por el reservorio de calor de gas ideal. En general, aplicamos fuerzas a los dos pistones para lograr la compresión isotérmica reversible del gas ideal en el depósito de calor y la vaporización isotérmica reversible de una cantidad de líquido en el sistema. Porque\(q=-\hat{q}\), la magnitud del cambio de entropía para el entorno es igual a la del reservorio de calor de gas ideal. Todo el proceso es reversible, el cambio de entropía para el sistema y el cambio de entropía para el entorno suman a cero:\(\Delta S+\Delta \hat{S}=0\).
Podemos calcular el cambio de entropía para el reservorio de calor de gas ideal. En general, los\(\hat{n}\) moles de gas ideal en el reservorio de calor van del estado especificado por\({\hat{P}}_1\) y\(T_P\) al estado especificado por\({\hat{P}}_2\) y\(T_P\). De la relación general\(dS=T^{-1}{\left({\partial H}/{\partial T}\right)}_PdT-{\left({\partial V}/{\partial T}\right)}_PdP\),, con\(dT=0\), tenemos\(d\hat{S}=-\left(\hat{n}R/P\right)dP\) y
\[\Delta \hat{S}=-\hat{n}R \ln \frac{\hat{P}_2}{\hat{P}_1} =\hat{n}R \ln \frac{\hat{V}_2}{\hat{V}_1}\]
El cambio de entropía para el sistema es\(\Delta S=-\Delta \hat{S}\). Siempre y cuando llevemos a cabo el proceso de manera isotérmica y reversible, podemos determinar el cambio de entropía para el sistema simplemente midiendo las presiones (o volúmenes) inicial y final del reservorio de calor de gas ideal.
Cualquier Proceso Reversible
Si el sistema sufre un cambio reversible en el que la temperatura del sistema no es constante, podemos operar la máquina de medición de entropía esencialmente de la misma manera que antes. La única diferencia es que debemos ajustar la presión aplicada al sistema para que la temperatura del sistema cambie de la manera requerida para mantener el proceso reversible, es decir, para mantener el sistema en equilibrio. Entonces el cambio al sistema y el cambio al reservorio de calor de gas ideal ambos tienen lugar de manera reversible. A pesar de que las temperaturas cambian, el control adecuado de las presiones aplicadas asegura que el sistema esté siempre en un estado de equilibrio y que la temperatura del sistema esté siempre arbitrariamente cercana a la temperatura del reservorio de calor de gas ideal.
Podemos calcular el cambio de entropía para el reservorio de calor de gas ideal. En general, los\(\hat{n}\) moles de gas ideal en el reservorio de calor van del estado especificado por\({\hat{P}}_1\) y\({\hat{T}}_1\) al estado especificado por\({\hat{P}}_2\) y\({\hat{T}}_2\). Podemos evaluar el cambio de entropía para tomar el gas ideal del estado 1 al estado 2 por una trayectoria de dos pasos. Primero comprimimos el gas isotérmicamente en\({\hat{T}}_1\) de\({\hat{P}}_1\) a\({\hat{P}}_2\). Luego calentamos el gas a presión constante\({\hat{P}}_2\) de\({\hat{T}}_1\) a\({\hat{T}}_2\). Para el primer paso,\(d\hat{T}=0\), y, como antes, encontramos
\[\Delta {\hat{S}}_{isothermal}=-\hat{n}R{ \ln \frac{{\hat{P}}_2}{{\hat{P}}_1}\ }=\hat{n}R{ \ln \frac{{\hat{V}}_2}{{\hat{V}}_1}\ }\]
Para el segundo paso,\(d\hat{P}=0\), y
\[\Delta \hat{S}_{isobaric}=\int^{\hat{T}_2}_{\hat{T}_1} \frac{\hat{n}C_P}{T}dT= \hat{n}C_P \ln \frac{\hat{T}_2}{\hat{T}_1}\]
El cambio de entropía para el reservorio de calor de gas ideal es así
\[\Delta \hat{S}=\Delta \hat{S}_{isothermal}+\Delta \hat{S}_{isobaric}=-\hat{n}R \ln \frac{\hat{P}_2}{ \hat{P}_1}+ \hat{n}C_P \ln \frac{\hat{T}_2}{\hat{T}_1}\]
y tenemos\(\Delta S=-\Delta \hat{S}\).
El punto esencial de la máquina de medición de entropía es que podemos determinar el cambio de entropía para cualquier proceso sin saber nada del proceso excepto cómo controlar la presión y la temperatura del sistema para que el proceso ocurra de manera reversible. Por supuesto, esta razón por la que la máquina de medición de entropía no es un dispositivo práctico. Para controlar la máquina de la manera requerida, debemos saber cómo las propiedades termodinámicas del sistema se relacionan entre sí en el colector gibbsiano que define los estados de equilibrio del sistema. Si sabemos esto, entonces sabemos\({\left({\partial H}/{\partial T}\right)}_P\) y\({\left({\partial V}/{\partial T}\right)}_P\) para el sistema a lo largo de cualquier camino reversible, y podemos calcular el cambio de entropía para el sistema de la misma manera que calculamos el cambio de entropía para el reservorio de calor de gas ideal. Si tenemos la información necesaria para realizar la medición, podemos calcular el cambio de entropía sin usar la máquina.


