13.3: La termodinámica de la mezcla de gases ideales
- Page ID
- 73922
Cuando hablamos de la termodinámica de la mezcla, tenemos en mente un proceso muy particular. Por convención, el proceso de mezclar dos gases, llamarlos\(A\) y\(B\), es el proceso en el que los dos gases inicialmente ocupan recipientes separados, pero ambos se encuentran a una presión y temperatura comunes. (Denotamos la presión inicial común por “\(P_0\)”. \(P_0\)no debe confundirse con la constante\(P^o\).) El estado final después del proceso de mezcla es aquel en el que hay una mezcla homogénea de\(A\) y\(B\) a la misma temperatura que caracterizó el estado inicial. El volumen final es la suma de los volúmenes iniciales. Si los gases son ideales, la presión final es la misma que la presión inicial, y las presiones parciales son\(P_A={n_ART}/{\left(V_A+V_B\right)}\) y\(P_B={n_BRT}/{\left(V_A+V_B\right)}\).
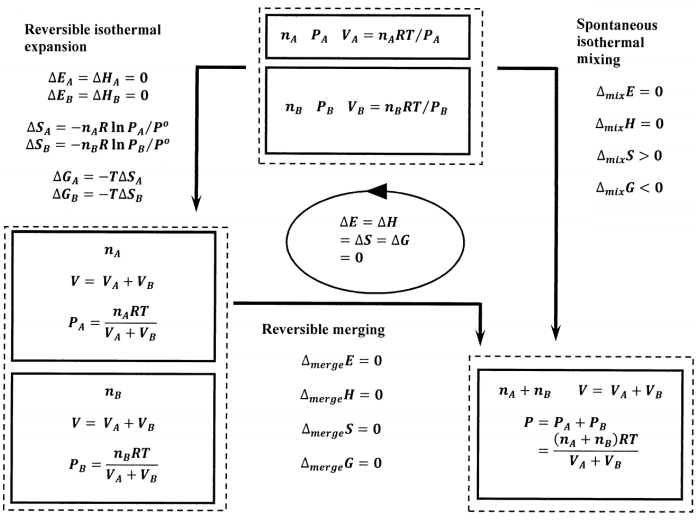
El proceso de mezcla está representado por el cambio en el lado derecho de la Figura 1. Los gases están siempre en contacto térmico con el entorno de temperatura constante. Imaginamos que juntamos los contenedores inicialmente separados y luego retiramos las paredes superpuestas. (O podemos imaginar conectar los dos contenedores por un tubo, cuyo volumen es insignificante, que permite que las moléculas se muevan de un recipiente a otro). La difusión molecular eventualmente hace que la concentración de cualquiera de los gases sea la misma en cualquier porción macroscópica de los volúmenes combinados. Esta mezcla difusiva comienza tan pronto como proporcionamos un camino para que las moléculas se muevan entre sus contenedores. La mezcla isotérmica es un proceso espontáneo. El proceso inverso no ocurre. La mezcla isotérmica es irreversible.
Dado que la temperatura es constante y los gases son ideales, la energía de las\(A\) moléculas es constante; así mismo, la energía de las\(B\) moléculas es constante. De ello se deduce que la energía de un sistema que contiene moléculas de\(A\) y\(B\) es independiente de sus concentraciones y que la energía de la mezcla es la suma de las energías de los componentes separados. Es decir, tenemos\({\Delta }_{mix}E=0\). Dado que el volumen y la presión del sistema de dos gases son constantes, se deduce que\({\Delta }_{mix}\left(PV\right)=0\) y\({\Delta }_{mix}H=0\). Volumen constante también significa eso\(w_{mix}=0\). De ello se deduce eso\(q_{mix}=0\), y eso\({\Delta }_{mix}\hat{S}=0\). Entonces, porque el proceso de mezcla es espontáneo, tenemos\({\Delta }_{mix}S>0\). Por último, ya que\({\Delta }_{mix}H=0\), tenemos\({\Delta }_{mix}G=-T{\Delta }_{mix}S<0\). Sin embargo, para poder calcular los valores de\({\Delta }_{mix}S=0\) y\({\Delta }_{mix}G<0\), debemos encontrar una ruta reversible para el cambio de estado que se produce durante la mezcla.
La trayectoria de dos pasos representada por los cambios a lo largo del lado izquierdo y la parte inferior de la Figura 1 es una trayectoria tan reversible. El primer paso es simplemente la expansión isotérmica reversible de los gases separados desde sus volúmenes iniciales (\(V_A\)y\(V_B\), respectivamente) hasta el volumen final común,\(V_A+V_B\). Al final de este paso, los dos gases aún se encuentran en contenedores separados. La expansión isotérmica reversible de un gas ideal es un proceso familiar; para este paso, sabemos:
\[\Delta E_A=\Delta H_A=0\]\[\Delta E_B=\Delta H_B=0\]
\[\Delta S_A=-n_AR \ln \left(P_A/P_0\right)>0\]\[\Delta S_B=-n_BR \ln \left(P_B/P_0\right) > 0\]
\[\Delta G_A=-T\Delta S_A<0\]\[\Delta G_B=-T\Delta S_B<0\]
Llamamos al cambio a lo largo de la parte inferior del diagrama el proceso de fusión. El proceso de fusión es la mezcla isotérmica reversible de las muestras de gas separadas, ocupando cada una inicialmente un volumen\(V_A+V_B\), de tal manera que el estado final tiene todas las moléculas de los dos gases en un mismo recipiente, cuyo volumen también es\(V_A+V_B\). Si bien el estado final del proceso de fusión es idéntico al estado final del proceso de mezcla, el estado inicial es claramente diferente.
Para gases ideales, resulta que todas las funciones termodinámicas permanecen inalteradas durante el proceso de fusión. En consecuencia, las funciones termodinámicas para mezclar son solo las sumas de las funciones termodinámicas para las expansiones reversibles de\(A\) y\(B\) por separado. Equiparando funciones termodinámicas para los dos caminos hacia el estado mixto, tenemos
\[{\Delta }_{mix}E=\Delta E_A+\Delta E_B+{\Delta }_{merge}E=0\]\[{\Delta }_{mix}H=\Delta H_A+\Delta H_B+{\Delta }_{merge}H=0\]
\[{\Delta }_{mix}S=\Delta S_A+\Delta S_B+{\Delta }_{merge}S=-n_AR \ln \left(P_A/P_0\right)-n_BRT \ln \left(P_B/P_0\right) >0\]
\[{\Delta }_{mix}G=-T{\Delta }_{mix}S<0\]
Las relaciones de presión son iguales a las fracciones molares de los compuestos en la mezcla. Por lo tanto, la entropía de la mezcla también viene dada por
\[{\Delta }_{mix}S=-n_AR{ \ln x_A\ }-n_BR{ \ln x_B\ }>0\]
Si calculamos la entropía de mezcla por mol de\(A\) —\(B\) -mezcla\({\Delta }_{mix}\overline{S}\),, encontramos
\[{\Delta }_{mix}\overline{S}=\frac{{\Delta }_{mix}S}{n_A+n_B}=-\left(\frac{n_A}{n_A+n_B}\right)R \ln x_A-\left(\frac{n_B}{n_A+n_B}\right)R \ln x_B=-x_AR \ln x_A-x_BR \ln x_B\]
Queda por probar nuestra afirmación de que las funciones termodinámicas se mantienen inalteradas durante el proceso de fusión. Que la energía esté inalterada se deduce del hecho de que la energía de un gas ideal depende únicamente de la temperatura; por lo tanto, es independiente de la presión y de la presencia de cualquier otra sustancia. Podemos dar un argumento cualitativo para la idea de que otras cantidades termodinámicas también están inalteradas. En este argumento, las funciones de entalpía, entropía y energía libre no se modifican porque las moléculas de gas ideales no interactúan entre sí. Si\(A\) las moléculas no interactúan con\(B\) las moléculas, se deduce que las propiedades de\(A\) las moléculas son independientes de si las\(B\) moléculas comparten el mismo contenedor o están presentes en un recipiente separado de volumen idéntico. A la misma temperatura, las\(A\) moléculas generan una presión\(P_A\), y las\(B\) moléculas generan independientemente una presión\(P_B\). Dado que estas presiones se generan de manera independiente, concluimos que la presión total es la suma de las dos presiones parciales, que es, por supuesto, solo la ley de Dalton de presiones parciales. El mismo argumento se aplica a las funciones de entalpía, entropía y energía libre, por lo que estas también deberían permanecer inalteradas durante el proceso de fusión.
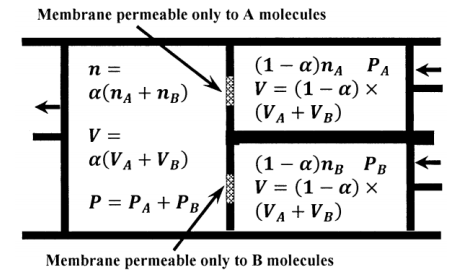
También podemos crear un dispositivo en el que podamos, en concepto, llevar a cabo el proceso de fusión isotérmica reversible y calcular los cambios de la función termodinámica. (Nos basamos en el argumento anterior para establecer la ley de Dalton de presiones parciales y la conclusión de que\({\Delta }_{merge}E=0\). Utilizamos el dispositivo para mostrar a partir de estos resultados que no hay cambio en las otras funciones termodinámicas). El dispositivo se esboza en la Figura 2, en una etapa intermedia del proceso. Consta de tres cilindros, cada uno cerrado por un pistón sin fricción. El primero contiene gas no fusionado\(A\), el segundo contiene gas\(B\) no fusionado y el tercero contiene la mezcla que resulta de fusionarlos. La\(A\) culata del cilindro se comparte con parte de la culata del cilindro de fusión. De igual manera, la\(B\) culata del cilindro se comparte con otra parte de la culata del cilindro de fusión. Suponemos que las culatas\(A\) y las\(B\) culatas están compuestas en parte de membranas permeables a los gases selectivas de moléculas. La membrana en la cabeza del\(A\) cilindro permite la difusión de\(A\) moléculas en cualquier dirección, pero no permite que\(B\) las moléculas pasen. La membrana en la cabeza del\(B\) cilindro permite la difusión de\(B\) moléculas en cualquier dirección, pero no permite que\(A\) las moléculas pasen.
En el cilindro de fusión, acumulamos reversiblemente\(A\) moléculas del\(A\) cilindro y\(B\) moléculas del\(B\) cilindro. Esto lo conseguimos controlando las presiones en los tres cilindros. La presión en el\(A\) cilindro es siempre infinitesimalmente mayor que\(P_A\). La presión en el\(B\) cilindro es siempre infinitesimalmente mayor que\(P_B\). La presión parcial de\(A\) en el cilindro de fusión es infinitesimalmente menor que\(P_A\); la presión parcial de\(B\) en el cilindro de fusión es infinitesimalmente menor que\(P_B\); y la presión total en el cilindro de fusión es infinitesimalmente menor que\(P_A+P_B\). (Siempre hay una diferencia en la presión total a través de cada membrana). El sistema consiste en el contenido de los cilindros. El trabajo se realiza en el sistema por las fuerzas que actúan sobre los\(B\) cilindros\(A\) y. El trabajo es realizado por el sistema en los alrededores ya que el cilindro de fusión se llena con la mezcla.
En lo que respecta al\(A\) cilindro, el proceso es reversible porque la presión debida a las\(A\) moléculas es infinitesimalmente mayor en el\(A\) cilindro que en el cilindro de fusión. Por lo tanto, una disminución muy pequeña en la presión del\(A\) cilindro provocaría que el flujo neto de\(A\) moléculas cambiara de dirección. Lo mismo ocurre con el\(B\) cilindro.
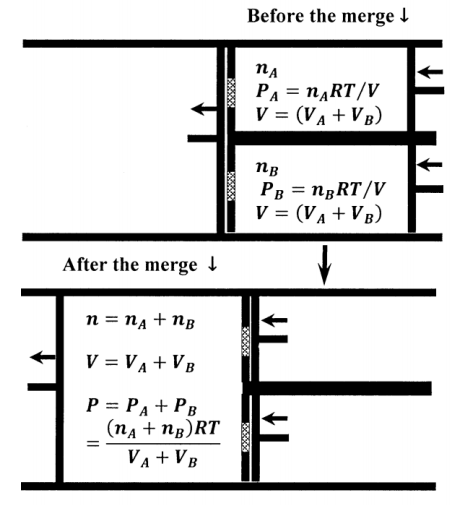
Los estados inicial y final del aparato cuando lo usamos para fusionar\(n_A\) moles de\(A\) at\(P_A\) con\(n_B\) moles de\(B\) at se\(P_A\) muestran en la Figura 3. Dejar\(V_{mix}=V_A+V_B\) ser la suma de los volúmenes iniciales de cilindros\(A\) y\(B\). Este es también el volumen final del cilindro de fusión. El trabajo reversible realizado en el\(A\) cilindro es
\[w^{rev}_A=-\int^0_{V_A+V_B}{P_AdV}=-P_A\left(0-V_A V_B\right)=P_A\left(V_A+V_B\right)=n_ART\]
De igual manera, el trabajo en el\(B\) cilindro es
\[w^{rev}_B=P_B\left(V_A+V_B\right)=n_BRT\]
En el cilindro de fusión está
\[w^{rev}_{A+B}=-\left(P_A+P_B\right)\left(V_A+V_B\right)=-\left(n_B+n_B\right)RT\]
Para el proceso de fusión el trabajo neto es
\[w^{rev}_{merge}=w^{rev}_A+w^{rev}_B+w^{rev}_{A+B}=0\]
y el cambio neto en el producto presión-volumen es
\[{\Delta }_{merge}\left(PV\right)=\left(P_A+P_B\right)\left(V_A+V_B\right)\]\[-P_A\left(V_A+V_B\right)-P_B\left(V_A+V_B\right)\]\[=0\]
Ya que la temperatura constante asegura eso\({\Delta }_{merge}E=0\), se deduce de\({\Delta }_{merge}\left(PV\right)=0\) eso\({\Delta }_{merge}H=0\), y de\(w^{rev}_{merge}=0\) eso\(q^{rev}_{merge}=0\). Dado que el proceso de fusión es reversible, tenemos también eso\({\Delta }_{merge}S=0\) y\({\Delta }_{merge}G=0\).
Estos argumentos pueden extenderse a la fusión de cualquier cantidad de gases ideales. En el estado inicial para este proceso de fusión cada gas se encuentra a la misma temperatura, pero ocupa un contenedor separado; todos estos contenedores tienen el mismo volumen. Cada gas puede estar a una presión diferente. En el estado final, todos los gases ocupan un contenedor común, cuyo volumen es el mismo que el volumen común de sus contenedores iniciales. La temperatura de la mezcla en el estado final es igual a la temperatura inicial común de los gases separados. En el estado final, la presión parcial de cada gas es igual a su presión en el estado inicial. Para cualquier cantidad de gases, tenemos
\[{\Delta }_{merge}E={\Delta }_{merge}H={\Delta }_{merge}S={\Delta }_{merge}G=0\]
De igual manera, estos argumentos pueden extenderse a la mezcla de múltiples gases ideales, todos a la misma presión y temperatura originales, en un volumen final que es igual a la suma de los volúmenes iniciales y está a la temperatura original. Si existen\(\omega\) tales gases,
\[{\Delta }_{mix}E={\Delta }_{mix}H=0\]
\[{\Delta }_{mix}S=\sum^{\omega }_{i=1}{-n_iR \ln x_i}>0\]
\[{\Delta }_{mix}G=-T{\Delta }_{mix}S<0\]


