13.7: La Energía Libre de Gibbs de Formación y Equilibrio en las Reacciones de Gases Ideales
- Page ID
- 73932
En la Sección 13.6, desarrollamos una relación entre el cambio estándar de energía libre de Gibbs para una reacción y la constante de equilibrio para esa reacción. El cambio estándar de energía libre de Gibbs para una reacción es una cantidad específica de energía, que depende únicamente de la temperatura. En el Capítulo 11, desarrollamos la energía libre de formación de Gibbs para una sustancia en su estado estándar. Afiramos que es conveniente establecer la energía libre de Gibbs de cada sustancia en su estado estándar igual a su energía libre de Gibbs de formación. Ahora podemos ver la razón: Cuando expresamos el molar Gibbs energía libre de un gas ideal como
\[{\overline{G}}_A\left(P_A\right)={\Delta }_fG^o\left(A,P^o\right)+RT{ \ln \frac{P_A}{P^o}\ }\]
\({\overline{G}}_A\left(P_A\right)\)es el cambio de energía libre de Gibbs para producir un mol de gas ideal\(A\), a presión\(P_A\), a partir de los elementos a la misma temperatura. Debido a que las energías libres de Gibbs de los reactivos y productos se miden desde un punto de partida común, podemos utilizarlas para calcular el cambio de energía libre de Gibbs para su reacción.
Para demostrar el papel de nuestra elección de los elementos como estado de referencia para las energías libres de Gibbs de sustancias químicas, solo necesitamos expandir el ciclo de energía libre de Gibbs en la Figura 4. En la Figura 6, se introduce el cambio de energía libre de Gibbs para producir los componentes separados del sistema muy grande.
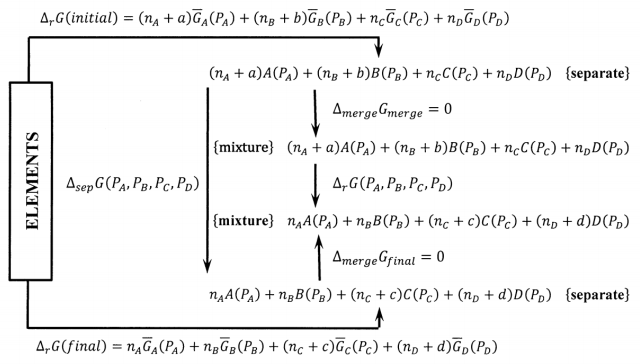
Calculando el cambio de energía libre de Gibbs en el sentido de las agujas del reloj alrededor del ciclo en el que los elementos se convierten primero en reactivos aislados, luego en componentes de un gran sistema de equilibrio, luego en productos separados, y finalmente de vuelta a los elementos, encontramos
\[\mathrm{0=}{\mathrm{\Delta }}_fG\left(initial\right) + {\mathrm{\Delta }}_{merge}G_{initial}\]\[ + {\mathrm{\Delta }}_rG\left(P_A\mathrm{,\ }P_B\mathrm{,\ }P_C\mathrm{,\ }P_D\right) + {\mathrm{\Delta }}_{merge}G_{final} + {\mathrm{\Delta }}_fG\left(final\right)\]
Dado que las presiones parciales\(P_A\),\(P_B\),\(P_C\), y\(P_D\) caracterizar el sistema en equilibrio,\({\mathrm{\Delta }}_rG\left(P_A\mathrm{,\ }P_B\mathrm{,\ }P_C\mathrm{,\ }P_D\right)\mathrm{=0}\). Además,\({\mathrm{\Delta }}_{merge}G_{initial} = {\mathrm{\Delta }}_{merge}G_{final}\) = 0, por lo que la ecuación para el cambio de energía libre de Gibbs alrededor del ciclo simplifica a
\[\begin{aligned} 0 & ={\Delta }_fG\left(initial\right)-{\Delta }_fG\left(final\right) \\ ~ & =a \overline{G}_A\left(p_A\right)+b \overline{G}_B\left(p_B\right)-c \overline{G}_C\left(p_C\right)-d \overline{G}_D\left(p_D\right) \\ ~ & =a\ {\Delta }_fG^o\left(A,P^o\right)+b\ {\Delta }_fG^o\left(B,P^o\right)-c {\Delta }_fG^o\left(C,P^o\right) -d {\Delta }_fG^o\left(D,P^o\right) +RT \ln p^a_A\ +RT \ln p^b_B -RT \ln p^c_C-RT \ln p^d_D \\ ~ & =-{\Delta }_rG^o-RT \ln \frac{p^c_Cp^d_D}{p^a_Ap^b_B} \end{aligned}\]
Para que tengamos
\[{\Delta }_rG^o=-RT{ \ln \frac{p^c_Cp^d_D}{p^a_Ap^b_B}\ }\]
Para ilustrar la aplicación de estas ideas, consideremos el equilibrio en la oxidación del óxido nítrico a dióxido de nitrógeno
\[2\ NO+O_2\rightleftharpoons 2\ NO_2\]
A 800 K, la energía libre estándar de Gibbs de formación de óxido nítrico es\(+81.298\ \mathrm{kJ}\ {\mathrm{mol}}^{-1}\), y la del dióxido de nitrógeno es\(+83.893\ \mathrm{kJ}\ {\mathrm{mol}}^{-1}\). Por lo tanto, el cambio estándar de energía libre de Gibbs para la oxidación es\(+5,190\ \mathrm{J}\ {\mathrm{mol}}^{-1}\), y la constante de equilibrio es
\[K_P=\mathrm{exp}\left(-\frac{{\Delta }_rG^o}{RT}\right)=0.458\]
Supongamos que\(O_2\) se mezclan un mol de\(NO_2\) y un mol de, que la mezcla se termostasa a 800 K, y que la presión aplicada permanece constante a 10 bar mientras la reacción va al equilibrio.
Que el número de moles de\(NO\) presente en equilibrio sea\(n_{NO}\). Entonces los moles de\(NO_2\) y\(O_2\) presentes en equilibrio son\(n_{NO_2}\mathrm{=1-}n_{NO}\) y\(n_{O_2}=1+{n_{NO}}/{2}\). Las presiones parciales son\(P_{NO}={n_{NO}RT}/{V}\),\(P_{NO_2}={n_{NO_2}RT}/{V}\), y\(P_{O_2}={n_{O_2}RT}/{V}\), para que
\[K_P=\frac{{\left(\mathrm{1-}n_{NO}\mathrm{\ }\right)}^2}{n^2_{NO}\left(1+{n_{NO}}/{2}\right)\left({RT}/{V}\right)}\]El valor de\(RT/V\) depende de la presión total; tenemos
\[P=P_{NO}+P_{NO_2}+P_{O_2}=\left(2+{n_{NO}}/{2}\right)\left({RT}/{V}\right)=10\ \mathrm{bar}\]para que
\[\frac{RT}{V}=\frac{20}{4+n_{NO}}\]
y
\[K_P=\frac{{\left(\mathrm{1-}n_{NO}\mathrm{\ }\right)}^2\left(4+n_{NO}\right)}{10n^2_{NO}\left(2+n_{NO}\right)}=0.458\]
Resolviendo, encontramos\(n_{NO}=0.388\).


