13.8: Equilibrio cuando un componente también está presente como una fase condensada
- Page ID
- 73945
Supongamos que el sistema de equilibrio muy grande con componentes de gas ideales a presiones\(P_A\)\(P_B\),\(P_C\),\(P_D\), y, también contiene una cantidad de líquido\(A\). (Por el momento, asumimos que este es líquido puro\(A\); componentes\(B\),\(C\), y\(D\) son insolubles en líquido\(A\).) Si este sistema incrementado está en equilibrio, sabemos que el líquido\(A\) está en equilibrio de fase con el gas ideal\(A\) a presión\(P_A\). Es decir,\(P_A\) es la presión de vapor del líquido\(A\) a la temperatura fija que estamos considerando, y el cambio de energía libre de Gibbs para convertir líquido\(A\) a su gas ideal en\(P_A\) es cero. Mientras el líquido esté en equilibrio de fase con su gas ideal, la relación entre las presiones parciales ideales del gas y el cambio de energía libre de Gibbs estándar para la reacción no se ve afectada por la presencia del líquido. Estas mismas consideraciones se aplican cuando el sistema de equilibrio muy grande contiene tanto gas ideal como sólido\(A\), siempre\(A\) y cuando la presión de sublimación de equilibrio sea igual a la presión parcial del gas ideal A,\(P_A\).
Ahora, supongamos que esa sustancia\(A\) es un líquido o sólido no volátil. En este caso, es posible que no podamos medir la energía libre de Gibbs estándar de formación de gas ideal\(A\). Desde un punto de vista práctico, esta es una consideración importante; si no podemos encontrar la energía libre de Gibbs estándar de formación del gas ideal, no podemos usarla para calcular las constantes de equilibrio. Desde un punto de vista teórico, es menos crucial; podemos imaginar razonablemente que cualquier sustancia tiene una presión de vapor finita a cualquier temperatura, aunque el valor sea demasiado pequeño para medirlo experimentalmente. Podemos razonar sobre la relación de la presión de vapor de equilibrio con otras cantidades, ya sea que podamos medirla o no.
Si la sustancia\(A\) es un líquido (o sólido) no volátil a la temperatura de interés, es útil modificar el ciclo introducido en la sección anterior. Podemos encontrar la energía de formación libre de Gibbs estándar para el líquido a partir de mediciones térmicas, y podemos usar líquido\(A\) en lugar de gas ideal\(A\) como estado estándar. Si\(A\) es no volátil, está presente en el sistema de equilibrio solo como el líquido. Para los propósitos actuales, nuevamente asumimos que los demás componentes son insolubles en líquido\(A\); entonces, la única diferencia entre\(A\) en su estado estándar y\(A\) en el sistema de equilibrio es que la presión\(A\) en su estado estándar es de una barra y la presión sobre el líquido \(A\)en el sistema de equilibrio es\(P=P_B+P_C+P_D\). Por lo tanto, cuando los\(a\) moles de líquido\(A\) pasan de su estado estándar al sistema de equilibrio, el cambio de energía libre de Gibbs es
\[{\Delta }_{press}G_A=a\int^P_{P^o}{{\overline{V}}^{\textrm{⦁}}_A}\left(\ell \right)dP\]
donde\({\overline{V}}^{\textrm{⦁}}_A\left(\ell \right)\) está el volumen molar de líquido puro\(A\). Cuando se\(A\) producen\(a\) moles de líquido a la presión de equilibrio de los elementos, el cambio de energía libre de Gibbs es
\[a{\overline{G}}_A\left(\ell ,P\right)=a\ {\Delta }_fG^o\left(A,\ell \right)+a\int^P_{P^o}{{\overline{V}}^{\textrm{⦁}}_A}\left(\ell \right)dP\]
En la Sección 15.3, prestamos mayor atención al valor de esta integral; por ahora, simplemente señalemos que es despreciable esencialmente en todas las circunstancias. Estas consideraciones significan que podemos modificar el lado izquierdo del ciclo en la Figura 5 como se indica en la Figura 7.
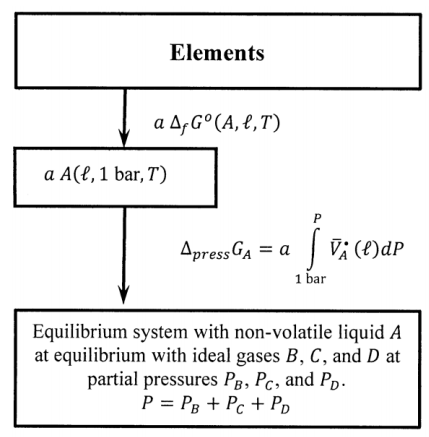
Cuando sumamos alrededor del ciclo modificado de la misma manera que antes, encontramos
\[0=a\ {\Delta }_fG^o\left(A,\ell \right)+b\ {\Delta }_fG^o\left(B,P^o\right)-c\ {\Delta }_fG^o\left(C,P^o\right)\]\[-d\ {\Delta }_fG^o\left(D,P^o\right)+a\int^P_{P^o}{{\overline{V}}^{\textrm{⦁}}_A}\left(\ell \right)dP+RT{ \ln p^b_B\ }\]\[-RT{ \ln p^c_C-RT{ \ln p^d_D\ }\ }\]
donde hemos complementado nuestra notación para enfatizar que\(A\) es un líquido no volátil mientras\(B\),\(C\), y\(\ D\) son gases ideales. Seguimos utilizando\({\Delta }_rG^o\) para representar la diferencia entre las energías libres estándar de Gibbs de los productos y las de los reactivos. En las circunstancias actuales, tenemos
\[{\Delta }_rG^o=\ c\ {\Delta }_fG^o\left(C,P^o\right)+d\ {\Delta }_fG^o\left(D,P^o\right)-a\ {\Delta }_fG^o\left(A,\ell \right)-b\ {\Delta }_fG^o\left(B,P^o\right)\]
Tomando el valor de la integral como cero, nuestro resultado se simplifica a
\[{\Delta }_rG^o=-RT{ \ln \frac{p^c_Cp^d_D}{p^b_B}\ }\]
De nuevo hemos llegado a la conclusión de que la “concentración” de un sólido o líquido puro se puede establecer igual a la unidad en la expresión constante de equilibrio para una reacción en la que participa. Cuando lo hacemos, debemos utilizar la energía libre de Gibbs de formación de la fase condensada en el cálculo de\({\Delta }_rG^o\).


