14.12: Relación de Fugacidad y Actividad Química
- Page ID
- 74611
Si bien desarrollamos el concepto de fugacidad pensando en la energía libre de Gibbs de un gas puro real, nuestra definición significa que la fugacidad de una sustancia en cualquier sistema depende únicamente de la diferencia entre el potencial químico en ese sistema y su potencial químico en el estado estándar. No hay razón para limitar la definición de fugacidad a los sistemas gaseosos. Lo generalizamos: Nuestra relación definitoria especifica la fugacidad de cualquier sustancia en cualquier sistema en función de la diferencia entre su potencial químico en ese sistema y su potencial químico en su hipotético estado estándar de gas ideal.
Dado que la energía libre de Gibbs de un sistema arbitrario depende de la presión, temperatura y composición del sistema, la fugacidad de cualquier componente también depende de estas variables. Sin embargo, existe una restricción adicional sobre la fugacidad. A una presión del sistema suficientemente baja, los gases en cualquier sistema se comportan idealmente y obedecen a la ley de Boyle de presiones parciales; la integral en la ecuación del coeficiente de fugacidad se convierte en cero y el coeficiente de fugacidad se convierte en unidad. En el límite como\(P\to 0\),\(f_A\to x_AP\), donde\(x_A\) está la fracción molar de\(A\) en la fase gaseosa. A una presión suficientemente baja, cualquier mezcla de gases se comporta idealmente, y la fugacidad de una especie constituyente se vuelve igual a su presión parcial en fase gaseosa. (Para una mezcla de gases ideales, la fugacidad de un componente siempre es igual a su presión parcial).
En la Sección 14.10, definimos la actividad del componente A en un sistema arbitrario por la relación
\[{\mu }_A={\widetilde{\mu }}^o_A+RT{ \ln \left[{\tilde{a}}_A\left(P,T,c_A,c_B,c_C,\dots \right)\right]\ }\]
donde\({\widetilde{\mu }}^o_A\) está el potencial químico de\(A\) en un estado estándar de actividad en el que estipulamos que la actividad de\(A\) es unidad. Dado que las ecuaciones definitorias para la actividad y para la fugacidad son formalmente idénticas, la distinción entre actividad y fugacidad radica en nuestras elecciones de estados estándar y en los hechos de que la actividad es adimensional mientras que la fugacidad tiene las unidades de presión. Si utilizamos el hipotético estado estándar ideal-gas para la actividad y medimos la concentración en barras, la distinción práctica entre actividad y fugacidad desaparece. Podemos ver la fugacidad como una especialización del concepto de actividad.
En resumen: La función de fugacidad demuestra ser una forma útil de expresar la diferencia entre el potencial químico de una sustancia en dos estados diferentes. La fugacidad se mide en barras con el hipotético estado estándar de gas ideal como estado de referencia. Agregamos la actividad química a nuestra lista de propiedades termodinámicas útiles porque extiende las ventajas de la representación de fugacidad a componentes no volátiles de sistemas que contienen fases condensadas. El estado estándar para la actividad puede ser cualquier estado particular de cualquier sistema conveniente que contenga la sustancia. Definimos la actividad de la sustancia en este sistema de referencia como unidad. (Al igual que con el hipotético estado estándar de gas ideal, a menudo encontramos útil definir un sistema hipotético como el estado estándar para la actividad). El potencial químico de la sustancia en el sistema de estado estándar es, por definición, el potencial químico estándar\({\widetilde{\mu }}^o_A\), para esta escala de actividad particular.
En lo que resta de este capítulo y en los Capítulos 15 a 17, consideramos propiedades y aplicaciones adicionales de fugacidad y actividad química. Sin embargo, antes de hacerlo, hacemos una divagación para observar que podemos elegir una definición alternativa de actividad: la actividad química puede definirse como una relación de fugacidades. Consideremos tres sistemas que contienen sustancia\(A\).
El primero es el gas puro\(A\) en su hipotético estado estándar de gas ideal a temperatura\(T\),\(A\left({HIG}^o,T\right)\). En este estado, la fugacidad de\(A\) es la unidad,\(f_A\left({HIG}^o,T\right)=1\ \mathrm{bar}\). El potencial químico de\(A\) es el potencial químico de estado estándar, que equiparamos a la energía de formación libre de Gibbs:
\[{\overline{G}}_A\left({HIG}^o,T\right)={\Delta }_fG^o\left(A,{HIG}^o,T\right)={\mu }^o_A\]
El segundo es un sistema que definimos como el estado estándar para la actividad de\(A\) a temperatura\(T\). Aparte de la conveniencia, no hay razón para preferir ningún sistema en particular para este rol. Denotamos este sistema como\(A\left(activity\ standard\ state,T\right)\) o, para abreviar,\(A\left(ss,T\right)\). Por definición, la actividad de\(A\) en este estado es la unidad,\({\tilde{a}}^o_A\left(ss\right)=1\), y el potencial químico de\(A\) en este sistema es el potencial químico estándar para esta escala de actividad particular:\({\overline{G}}_A\left(ss,T\right)={\widetilde{\mu }}^o_A\). Denotamos la fugacidad de\(A\) en este estado como\(f_A\left(ss\right)\). Por nuestra definición de fugacidad, tenemos
\[{\widetilde{\mu }}^o_A={\mu }^o_A+RT{ \ln \left[\frac{f_A\left(ss\right)}{f_A\left({HIG}^o\right)}\right]\ }\]
El tercero es un sistema arbitrario que denotamos como\(A\left(P,T,c_A,c_B,c_C,\dots \right)\). Denotamos el potencial químico, fugacidad y actividad\(A\) de este sistema como\({\overline{G}}_A\left(P,T,c_A,c_B,c_C,\dots \right)={\mu }_A\left(P,T,c_A,c_B,c_C,\dots \right)\)\(f_A\left(P,T,c_A,c_B,c_C,\dots \right)\), y\({\tilde{a}}_A\left(P,T,c_A,c_B,c_C,\dots \right)\), respectivamente. Por nuestra definición de fugacidad, tenemos
\[{\mu }_A\left(P,T,c_A,c_B,c_C,\dots \right)={\mu }^o_A+RT{ \ln \left[\frac{f_A\left(P,T,c_A,c_B,c_C,\dots \right)}{f_A\left({HIG}^o\right)}\right]\ }\]
y por nuestra definición de actividad,
\[{\mu }_A\left(P,T,c_A,c_B,c_C,\dots \right)={\widetilde{\mu }}^o_A+RT{ \ln \left[{\tilde{a}}_A\left(P,T,c_A,c_B,c_C,\dots \right)\right]\ }\]
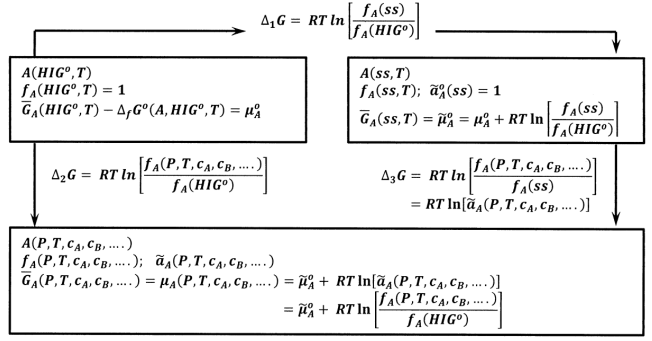
La Figura 2 resume las relaciones entre las energías libres de Gibbs de estos tres estados de sustancia\(A\). Del ciclo en la Figura 2, tenemos\({\Delta }_1G+{\Delta }_3G={\Delta }_2G\), de manera que
\[RT{ \ln \left[\frac{f_A\left(ss,T\right)}{f_A\left({HIG}^o\right)}\right]+RT{ln \left[\frac{f_A\left(P,T,c_A,c_B,\dots .\right)}{f_A\left(ss,T\right)}\right]\ }\ }\]\[=RT{ \ln \left[\frac{f_A\left(P,T,c_A,c_B,c_C,\dots \right)}{f_A\left({HIG}^o\right)}\right]\ }\]\[=RT{ \ln \left[{\tilde{a}}_A\left(P,T,c_A,c_B,\dots .\right)\right]\ }\]
y\[{\tilde{a}}_A\left(P,T,c_A,c_B,c_C,\dots \right)=\frac{f_A\left(P,T,c_A,c_B,c_C,\dots \right)}{f_A\left(ss,T\right)}\]
Es decir, la actividad de una sustancia en un sistema particular siempre es igual a su fugacidad en ese sistema dividido por su fugacidad en el estado estándar para la actividad. A partir de esta relación, es evidente que la actividad es siempre una función adimensional de las concentraciones.


