15.4: Estados estándar para la fugacidad y actividad de un sólido puro
- Page ID
- 73844
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Si la sustancia\(A\) es un líquido a una barra y la temperatura de interés, el líquido puro\(A\) es el estado estándar para el cálculo de la entalpía y la energía libre de Gibbs de formación. A partir de mediciones térmicas, podemos encontrar el estándar Gibbs energía libre de formación de este líquido,\({\Delta_fG}^o\left(A,\ell \right)=\mu^{\textrm{⦁}}_A\left(\ell ,P^o\right)\). Si podemos medir la presión de vapor de la sustancia y encontrar una ecuación de estado que describa el comportamiento del vapor real, también podemos encontrar su fugacidad y la energía libre estándar de Gibbs de formación de su hipotético gas ideal,\({\Delta_fG}^o\left(A,{HIG}^o\right)=\mu^o_A\left({HIG}^o\right)\). Del principio de que el potencial químico de la sustancia\(A\) es el mismo en dos fases cualesquiera que estén en equilibrio, se deduce que la fugacidad es la misma en cada fase.
Si elegimos el hipotético estado estándar de gas ideal como el estado estándar para la actividad de\(A\), entonces la actividad y la fugacidad son lo mismo, y el potencial químico del estado estándar es lo mismo que la energía libre de Gibbs de formación del hipotético gas ideal.
\[\mu^o_A={\widetilde\mu}^o_A=\Delta_fG^o\left(A,{HIG}^o\right)\]
(el estado estándar de actividad es el gas ideal hipotético)
Alternativamente, podemos elegir el líquido puro como estado estándar para la actividad de\(A\). En este caso, hay dos opciones más: Podemos elegir el líquido puro ya sea a una presión bar,\(P^o\), o a su presión de vapor de equilibrio,\(P^{\textrm{⦁}}_{vp}\). Si elegimos el líquido puro en\(P^o\), tenemos
\[{\widetilde\mu}^o_A=\mu^{\textrm{⦁}}_A\left(\ell ,P^o\right)=\Delta_fG^o\left(A,{\ell ,P}^o\right)\]
(el estado estándar de actividad es el líquido puro en\(P^o\))
En el Capítulo 16, vemos que el líquido puro at\(P^{\textrm{⦁}}_{vp}\) demuestra ser la opción más generalmente útil para\(A\) en una solución. Para el líquido puro en\(P^{\textrm{⦁}}_{vp}\), tenemos
\[{\widetilde\mu}^o_A=\mu^{\textrm{⦁}}_A\left(\ell ,P^{\textrm{⦁}}_{vp}\mathrm{\ }\right)\]
(el estado estándar de actividad es el líquido puro en\(P^{\textrm{⦁}}_{vp}\))
Evidentemente, es útil poder relacionar las cantidades\(\Delta_fG^o\left(A,{HIG}^o\right)\),\(\mu^{\textrm{⦁}}_A\left(\ell ,P^o\right)=\Delta_fG^o\left(A,{\ell ,P}^o\right)\), y\(\mu^{\textrm{⦁}}_A\left(\ell ,P^{\textrm{⦁}}_{vp}\mathrm{\ }\right)\) entre sí.
La diferencia entre la energía libre de Gibbs de formación del gas ideal en su hipotético estado ideal-gas y la energía libre de Gibbs de formación del líquido en su estado estándar es una cantidad que podemos llamar la energía libre de vaporización estándar de Gibbs,\({\Delta_{vap}G}^o\left(A,P^o\right)\), porque tanto la inicial como la final los estados están a una presión de una barra. A una temperatura arbitraria, un líquido a una barra no está en equilibrio con su propio gas ideal a una barra, y la energía libre de vaporización estándar de Gibbs no es cero. Tenemos
\[\begin{align*} \Delta_{vap}G^o\left(A,P^o\right) &= \Delta_fG^o\left(A,{HIG}^o\right)-\Delta_fG^o\left(A,{\ell ,P}^o\right) \\[4pt] &= \mu^o_A-\mu^{\textrm{⦁}}_A\left(\ell ,P^o\right) = RT \ln \left[\frac{f_A\left({HIG}^o\right)}{f^{\textrm{⦁}}_A\left(\ell ,P^o\right)}\right] \end{align*}\]
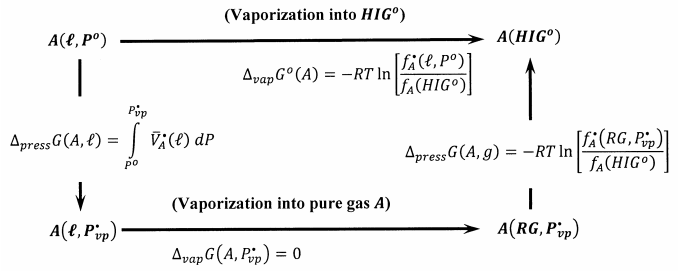
La Figura 1 describe un proceso reversible que toma un mol\(A\) del estado líquido puro a una barra a su hipotético estado estándar de gas ideal. Primero disminuimos reversiblemente la presión aplicada al líquido puro A hasta alcanzar su presión de vapor de equilibrio\(P^{\textrm{⦁}}_{vp}\), a la temperatura de interés. El cambio molar de energía libre de Gibbs para este proceso es
\[\Delta_{press}G\left(A,\ell \right) = \mu^{\textrm{⦁}}_A \left(\ell ,P^{\textrm{⦁}}_{vp}\right)-\Delta_fG^o\left(A,\ell ,P^o\right) = \mu^{\textrm{⦁}}_A\left(\ell ,P^{\textrm{⦁}}_{vp}\right)-\mu^{\textrm{⦁}}_A\left(\ell ,P^o\right) = \int^{P^{\textrm{⦁}}_{vp}}_{P^o}{\overline{V}^{\textrm{⦁}}_A}\left(\ell \right)\ dP\]
Para alcanzar el hipotético estado estándar de gas ideal, entonces evaporamos reversible e isotérmicamente un mol del líquido a su gas real. El cambio de energía libre de Gibbs para este proceso reversible es cero,\(\Delta_{vap}G\left(A,P^{\textrm{⦁}}_{vp}\right)=0\). Finalmente, expandimos isotérmica y reversiblemente el gas real a una presión arbitrariamente baja\(P^*\), convertimos conceptualmente el gas real en un gas ideal y comprimimos este gas ideal de\(P^*\) a una barra. El cambio de energía libre de Gibbs para estos últimos pasos es
\[\begin{align*} \Delta_{press}G\left(A,g\right) &= RT \ln \left[\frac{f_A\left({HIG}^o\right)}{f^{\textrm{⦁}}_A\left(RG,P^{\textrm{⦁}}_{vp}\right)}\right] \\[4pt]&= -RT{ \ln \left[\frac{P^{\textrm{⦁}}_{vp}}{P^o}\right]-\ }RT\int^{P^{\textrm{⦁}}_{vp}}_0{\left[\frac{\overline{V}^{\textrm{⦁}}_A\left(g\right)}{RT}-\frac{1}{P}\right]}dP \end{align*}\]
para que también podamos expresar la energía libre estándar de Gibbs de vaporización como
\[\begin{align*} \Delta_{vap}G^o\left(A,P^o\right) &= \Delta_{press}G\left(A,\ell \right)+\Delta_{press}G\left(A,g\right) \\[4pt]&=\int^{P^{\textrm{⦁}}_{vp}}_{P^o}{\overline{V}^{\textrm{⦁}}_A}\left(\ell \right)\ dP-RT{ \ln \left[\frac{P^{\textrm{⦁}}_{vp}}{P^o}\right]-\ }RT\int^{P^{\textrm{⦁}}_{vp}}_0{\left[\frac{\overline{V}^{\textrm{⦁}}_A\left(g\right)}{RT}-\frac{1}{P}\right]}dP \end{align*}\]
Equiparando expresiones para\({\Delta_{vap}G}^o\left(A,P^o\right)\), encontramos
\[\begin{align*} \Delta_fG^o\left(A,{HIG}^o\right)-{\Delta_fG}^o\left(A,\ell ,P^o\right) &= RT \ln \left[\frac{f_A\left({HIG}^o\right)}{f^{\textrm{⦁}}_A\left(\ell ,P^o\right)}\right] \\[4pt]&= \int^{P^{\textrm{⦁}}_{vp}}_{P^o}{\overline{V}^{\textrm{⦁}}_A}\left(\ell \right)\ dP-RT{ \ln \left[\frac{P^{\textrm{⦁}}_{vp}}{P^o}\right]-\ }RT\int^{P^{\textrm{⦁}}_{vp}}_0{\left[\frac{\overline{V}^{\textrm{⦁}}_A\left(g\right)}{RT}-\frac{1}{P}\right]}dP \end{align*}\]
Así, podemos encontrar la energía libre de Gibbs estándar de formación del gas ideal hipotético a partir de la energía libre estándar de Gibbs de formación del líquido, la presión de vapor de equilibrio de la sustancia pura y la ecuación de estado del gas puro:
\[ \begin{align*} \Delta_fG^o\left(A,{HIG}^o\right)-\Delta_fG^o\left(A,\ell ,P^o\right) &=\Delta_fG^o\left(A,{HIG}^o\right)-\mu^{\textrm{⦁}}_A\left(\ell ,P^o\right) \\[4pt] &=\int^{P^{\textrm{⦁}}_{vp}}_{P^o}{\overline{V}^{\textrm{⦁}}_A}\left(\ell \right)\ dP-RT{ \ln \left[\frac{P^{\textrm{⦁}}_{vp}}{P^o}\right]-\ }RT\int^{P^{\textrm{⦁}}_{vp}}_0{\left[\frac{\overline{V}^{\textrm{⦁}}_A\left(g\right)}{RT}-\frac{1}{P}\right]}dP \end{align*}\]
Si el vapor de la sustancia se comporta como un gas ideal, la última integral desaparece. Si también descuidamos la integral del volumen molar del líquido, tenemos
\[{\Delta_fG}^o\left(A,{HIG}^o\right)={\Delta_fG}^o\left(A,\ell ,P^o\right)-RT{ \ln \left[\frac{P^{\textrm{⦁}}_{vp}}{P^o}\right]\ }=\mu^{\textrm{⦁}}_A\left(\ell ,P^o\right)-RT{ \ln \left[\frac{P^{\textrm{⦁}}_{vp}}{P^o}\right]\ }\](gas ideal)
y\(f^{\textrm{⦁}}_A\left(\ell ,P^o\right)=P^{\textrm{⦁}}_{vp}\).
En este desarrollo, suponemos que conocemos\({\Delta_fG}^o\left(A,\ell ,P^o\right)\) a partir de mediciones térmicas. Podemos calcular la diferencia de energía libre de Gibbs entre los estados estándar líquido e hipotético de gas ideal si tenemos una ecuación de estado para el vapor. El potencial químico en el hipotético estado estándar de gas ideal es
\[\mu^o_A\left({HIG}^o\right)={\Delta_fG}^o\left(A,{HIG}^o\right)\]
y el potencial químico del líquido puro
\[\mu^{\textrm{⦁}}_A\left(\ell ,P^o\right)={\Delta_fG}^o\left(A,\ell ,P^o\right)\]
se expresa en función de la fugacidad del líquido puro:
\[\mu^{\textrm{⦁}}_A\left(\ell ,P^o\right)=\mu^o_A\left({HIG}^o\right)+RT{ \ln \left[\frac{f^{\textrm{⦁}}_A\left(\ell ,P^o\right)}{f_A\left({HIG}^o\right)}\right]\ }\]
El formalismo de la actividad proporciona una forma alternativa de expresar la misma información. Cuando elegimos el líquido puro a una barra como el estado estándar de actividad; establecemos\({\tilde{a}}_A\left(\ell ,P^o\right)=1\). Para esta escala de actividad, el potencial químico estándar se convierte en la energía libre de Gibbs de formación del líquido puro,\({\widetilde\mu}^o_A\left(\ell \right)={\Delta_fG}^o\left(A,\ell ,P^o\right)\). Dado que el potencial químico del hipotético estado estándar ideal-gas es\(\mu^o_A\left({HIG}^o\right){{=\Delta }_fG}^o\left(A,{HIG}^o\right)\), la relación de actividad se vuelve
\[{\Delta_fG}^o\left(A,{HIG}^o\right)-{\Delta_fG}^o\left(A,\ell ,P^o\right) =\mu^o_A\left({HIG}^o\right)-{\widetilde\mu}^o_A\left(\ell \right)=-\left(\mu^{\textrm{⦁}}_A\left({\ell ,P}^o\right)-\mu^o_A\left({HIG}^o\right)\right) =RT{ \ln \left[{\tilde{a}}_A\left({HIG}^o\right)\right]\ }\]
La comparación con la ecuación anterior muestra que\[{ \ln \left[{\tilde{a}}_A\left({HIG}^o\right)\right]\ }={ \ln \left[\frac{f_A\left({HIG}^o\right)}{f^{\textrm{⦁}}_A\left(\ell ,P^o\right)}\right]\ }\]
Si el líquido puro está en equilibrio con una mezcla de gases\(P^o\) en la que la fracción molar de\(A\) es\(x^{eq}_A\), la fugacidad del líquido puro es igual a la fugacidad del gas en la mezcla; es decir,
\[f^{\textrm{⦁}}_A\left(\ell ,P^o\right)=f_A\left(RG,x^{eq}_A,P^o\right)\]
para que
\[ \ln \left[{\tilde{a}}_A\left({HIG}^o\right)\right] = \ln \left[\frac{f_A\left({HIG}^o\right)}{f_A\left(RG,x^{eq}_A,P^o\right)}\right]\]
y
\[{\tilde{a}}_A\left({HIG}^o\right)=\frac{f_A\left({HIG}^o\right)}{f_A\left(RG,x^{eq}_A,P^o\right)}\]
Finalmente, tomemos el estado estándar de actividad como líquido puro\(A\) a 1 bar y encontremos la actividad de\(A\) en una mezcla arbitraria de gases reales cuya presión es\(P\) y en la que se\(A\) encuentra la fracción molar de\(x_A\). Representemos a este estado como\(A\left(RG,x_A,P\right)\). La actividad del gas real\(A\) en este estado es
\[{\tilde{a}}_A\left(RG,x_A,P\right)=\frac{f_A\left(RG,x_A,P\right)}{f^{\textrm{⦁}}_A\left(\ell ,P^o\right)} = \frac{f_A\left(RG,x_A,P\right)}{f_A\left(RG,x^{eq}_A,P^o\right)}\]
y el potencial químico es
\[\mu_A\left(RG,x_A,P\right)={\widetilde\mu}^o_A\left(\ell \right)+RT{ \ln \left[{\tilde{a}}_A\left(RG,x_A,P\right)\right]\ }\]
Si el gas real que está presente en la fracción molar\(x_A\) en un sistema cuya presión es\(P\) puede tratarse aproximadamente como un gas ideal, estos términos de fugacidad de gas pueden aproximarse como
\[f_A\left(RG,x_A,P\right)\approx f_A\left(IG,x_A,P\right)=x_AP\]y\[f_A\left(RG,x^{eq}_A,P^o\right)\approx f_A\left(IG,x^{eq}_A,P^o\right)=f_A\left(IG,P^{\textrm{⦁}}_{vp}\right)=P^{\textrm{⦁}}_{vp}\]
La actividad se convierte
\[{\tilde{a}}_A\left(RG,x_A,P\right)\approx {\tilde{a}}_A\left(IG,x_A,P\right)\approx {x_AP}/{P^{\textrm{⦁}}_{vp}}\]
y el potencial químico se convierte
\[\mu_A\left(RG,x_A,P\right)\approx \mu_A\left(IG,x_A,P\right)={\widetilde\mu}^o_A\left(\ell \right)+RT{ \ln \left(\frac{x_AP}{P^{\textrm{⦁}}_{vp}}\right)\ }\]


