15.6: Potencial Químico, Fugacidad y Equilibrio
- Page ID
- 73869
En el Capítulo 13, desarrollamos la relación entre el cambio estándar de energía libre de Gibbs para una reacción y la constante de equilibrio para esa reacción, bajo el supuesto de que todas las sustancias involucradas en la reacción se comportan idealmente. En la fase gaseosa, se comportan como gases ideales; cuando se disuelven en una solución, sus concentraciones son proporcionales a sus fracciones molares en una fase gaseosa en equilibrio con la solución.
Ahora podemos repetir este desarrollo usando las fugacidades en lugar de las presiones de las especies reaccionantes. Deja que la reacción sea
\[aA+bB\to cC+dD. \nonumber\]
Introducimos las reacciones que crean los reactivos y los productos en sus hipotéticos estados estándar de gas ideal a partir de sus elementos en sus estados estándar. El cambio de energía libre de Gibbs para crear los reactivos en sus hipotéticos estados estándar de gas ideal a partir de los elementos en sus estados estándar es
\[a{\Delta }_fG^o\left(A,{HIG}^o\right)+b{\Delta }_fG^o\left(B,{HIG}^o\right)\]
El cambio de energía libre de Gibbs para crear los productos en sus estados estándar, a partir del mismo conjunto de elementos, es
\[c{\Delta }_fG^o\left(C,{HIG}^o\right)+d{\Delta }_fG^o\left(D,{HIG}^o\right)\]
A continuación, se introduce un conjunto de procesos, cada uno de los cuales agrega una cantidad adicional de un reactivo o producto a un sistema muy grande en equilibrio. Es decir, transferimos\(a\) moles adicionales de puro\(A\) de su hipotético estado estándar de gas ideal a un sistema muy grande en el que se encuentra su fugacidad\(f_A\left(P,T,x_A,x_B,\dots .\right)\). El cambio de energía libre de Gibbs para este proceso es
\[a\ RT{ \ln \left[\frac{f_A\left(P,T,x_A,x_B,\dots .\right)}{f_A\left({HIG}^o\right)}\right]\ }\]
Los procesos correspondientes agregan\(b\) moles de puro\(B\) a fugacidad\(f_B\left(P,T,x_A,x_B,\dots .\right)\), etc. Estos procesos se esquematizan en la Figura 2. Dado que la fugacidad de una sustancia en cualquier estado es una medida rigurosa de la diferencia entre su potencial químico en ese estado y su potencial químico en su hipotético estado estándar ideal-gas, estos cambios de energía libre de Gibbs son exactos. Dado que el sistema muy grande está en equilibrio, no hay cambio de energía libre de Gibbs cuando un moles de\(A\) y\(b\) moles de\(B\) reaccionan de acuerdo con\(aA+bB\to cC+dD\).
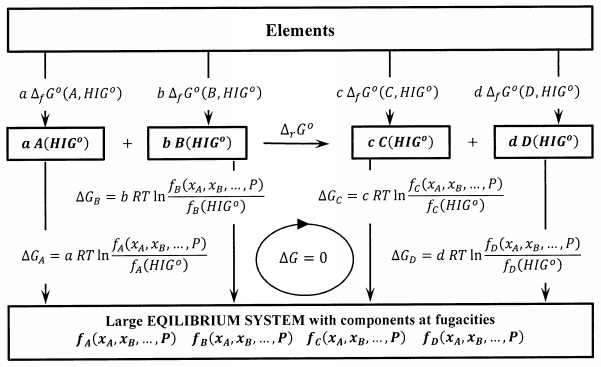
Calculemos el cambio de energía libre de Gibbs en sentido horario alrededor del ciclo reversible en la Figura 2. Los elementos en sus estados estándar se convierten primero en productos aislados, luego en componentes del sistema de equilibrio grande, luego en reactivos separados, y finalmente de vuelta a los elementos en sus estados estándar. Tenemos
\[0=c\ {\Delta }_fG^o\left(C,{HIG}^o\right)+d\ {\Delta }_fG^o\left(D,{HIG}^o\right)-a\ {\Delta }_fG^o\left(A,{HIG}^o\right)-b\ {\Delta }_fG^o\left(B,{HIG}^o\right)+c\ RT{ \ln \left[\frac{f_C\left(P,T,x_A,x_B,\dots .\right)}{f_C\left({HIG}^o\right)}\right]\ }+d\ RT{ \ln \left[\frac{f_D\left(P,T,x_A,x_B,\dots .\right)}{f_D\left({HIG}^o\right)}\right]\ }-a\ RT{ \ln \left[\frac{f_A\left(P,T,x_A,x_B,\dots .\right)}{f_A\left({HIG}^o\right)}\right]\ }-b\ RT{ \ln \left[\frac{f_B\left(P,T,x_A,x_B,\dots .\right)}{f_B\left({HIG}^o\right)}\right]\ } \nonumber\]
Para expresar las relaciones de fugacidad de manera más compacta, dejamos
\[f_A=\frac{f_A\left(P,T,x_A,x_B,\dots .\right)}{f_A\left({HIG}^o\right)}\]
etc. Dejar
\[{\Delta }_rG^o=c\ {\Delta }_fG^o\left(C,{HIG}^o\right)+d\ {\Delta }_fG^o\left(D,{HIG}^o\right)-a\ {\Delta }_fG^o\left(A,{HIG}^o\right)-b\ {\Delta }_fG^o\left(B,{HIG}^o\right)\]
la energía libre de Gibbs alrededor de este ciclo reversible simplifica a\[{\Delta }_rG^o=-RT{ \ln \frac{f^c_Cf^d_D}{f^a_Af^b_B}\ }\]
Podemos expresar el criterio de equilibrio como
\[K_f=\frac{f^c_Cf^d_D}{f^a_Af^b_B}\]
donde
\[K_f=\mathrm{exp}\left(\frac{-{\Delta }_rG^o}{RT}\right)\]
Introducimos el subíndice, “\(f\)”, para indicar que la constante de equilibrio,\(K_f\), es una función de las fugacidades de las sustancias reaccionantes. Estas relaciones son paralelas a las que encontramos para el equilibrio entre los gases ideales, con fugacidades de gas real que reemplazan las presiones ideales de gas.
Como lo hicimos cuando consideramos los equilibrios ideal-gas, supongamos que el sistema de equilibrio muy grande contiene una fase líquida en la que los reactivos y productos son solubles. La reacción también puede ocurrir en esta fase líquida, y esta reacción en fase líquida debe estar en equilibrio. Dado que el sistema está en equilibrio, cada especie química debe tener el mismo potencial químico en la solución que en la fase gaseosa. De ahí que las fugacidades y la constante de equilibrio basada en fugacidad sean las mismas en ambas fases.
En este punto, hemos logrado —en principio— una solución completa al problema de predecir la posición de equilibrio para cualquier reacción. Si podemos encontrar la energía libre de Gibbs de formación de cada sustancia en su hipotético estado estándar de gas ideal, y podemos encontrar su fugacidad en función de la composición y presión del sistema en el que se produce la reacción, podemos encontrar la constante de equilibrio y la composición de equilibrio del sistema.
En la práctica, una gran cantidad de sustancias no son volátiles. No se puede medir la energía libre de formación de Gibbs de sus hipotéticos estados estándar de gas ideal y sus fugacidades. Para tales sustancias, recurrimos a otros estados estándar y utilizamos actividades para expresar la constante de equilibrio.


