16.11: Propiedades coligativas - Depresión del punto de congelación
- Page ID
- 74172
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)El punto de ebullición de un disolvente puro, a una presión especificada, es la temperatura a la que el potencial químico del gas disolvente puro es igual al potencial químico del líquido disolvente puro. El punto de ebullición de una solución que contiene un soluto no volátil es la temperatura a la que el potencial químico del gas solvente puro es igual al potencial químico del solvente en la solución. En el apartado anterior, encontramos que el punto de ebullición de la solución es mayor que el punto de ebullición del disolvente puro. La diferencia de temperatura es la elevación del punto de ebullición.
De manera similar, el punto de congelación de un disolvente puro, a una presión especificada, es la temperatura a la que el potencial químico del disolvente sólido puro es igual al potencial químico del disolvente de líquido puro. El punto de congelación de una solución es la temperatura a la que el potencial químico del disolvente sólido puro es igual al potencial químico del disolvente en fase de solución. Encontramos que el punto de congelación de la solución es menor que el punto de congelación del solvente puro. La diferencia de temperatura es la depresión del punto de congelación.
En el caso de elevación del punto de ebullición, asumimos que el gas solvente puro no contiene soluto. En el caso de depresión del punto de congelación, asumimos que el sólido solvente puro no contiene soluto. Encontramos la relación entre la composición y la depresión del punto de congelación por un argumento muy similar al de la elevación del punto de ebullición. El estado de equilibrio en el experimento de depresión del punto de congelación se describe esquemáticamente en la Figura 8.
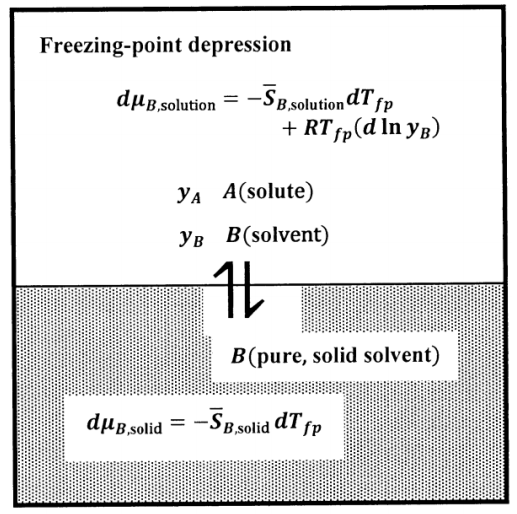
Dado que la temperatura de equilibrio disminuye a medida que aumenta la concentración de soluto, podemos realizar el estado de equilibrio experimentalmente enfriando lentamente una solución de la composición especificada. Determinamos la temperatura a la que se forma el primer cristal, muy pequeño, de disolvente sólido. Debido a que el disolvente puro se congela a una temperatura más alta que cualquier solución, el primer cristal formado es un disolvente sólido casi puro. Dado que este primer cristal es muy pequeño, su formación no cambia significativamente la composición de la solución. De ahí que la solución esté en equilibrio con el solvente sólido puro a esta temperatura; llamamos a esta temperatura el punto de congelación de la solución.
En la práctica, es común determinar el punto de fusión de una mezcla sólida en lugar del punto de congelación de la solución líquida. La temperatura de la mezcla sólida se incrementa lentamente. A medida que la mezcla se funde para formar una solución homogénea, la relación soluto-disolvente en la masa fundida se aproxima a la relación en la que se preparó la mezcla. Cuando el último pedazo de sólido se funde, la composición de la solución se conoce por la forma de preparación. Este último pedazo de sólido se funde a la temperatura más alta de cualquier parte de la mezcla. Por lo tanto, contiene la menor proporción de soluto. Si este último pedazo de sólido es de hecho disolvente puro, la temperatura a la que se funde el último sólido es el punto de congelación de la solución líquida. En el límite de que los experimentos de punto de congelación y punto de fusión se llevan a cabo de manera reversible, el estado del sistema de punto de congelación justo después de que el primer bit de sólido se congela es el mismo que el estado del sistema de punto de fusión justo antes de que el último bit de sólido se derrita.
Nuevamente especificamos la composición de la solución por las fracciones molares de\(A\) y\(\ B\). Dejamos que el soluto sea compuesto\(A\), y asumimos que su concentración es baja. Dejamos que la concentración de soluto sea\(y_A\), dónde\(y_A=1-y_B\),\(y_A\approx 0\) y\(y_B=1-y_A\approx 1\). La\(B\) solución\(A\) — está en equilibrio con el sólido puro\(B\). Queremos encontrar la temperatura a la que estas fases están en equilibrio. A esta temperatura,\(\mu_{B,\mathrm{solution}}=\mu_{B,\mathrm{solid}}\), y por lo tanto\(d\mu_{B,\mathrm{solution}}=d\mu_{B,\mathrm{solid}}\) para cualquier cambio que lleve al sistema a un nuevo estado de equilibrio.
Podemos analizar el fenómeno de depresión del punto de congelación para cualquier presión fija a la que el líquido puro\(B\) pueda estar en equilibrio con el sólido puro\(\ B\). Designemos la presión fija como\(P^{\#}\) y la temperatura del punto de congelación del líquido puro B, en\(P^{\#}\), as\(T_F\). Nuestro objetivo es encontrar la temperatura a la que una solución binaria está en equilibrio con el sólido puro\(B\) a la presión fija\(P^{\#}\). Dejamos\(T_{fp}\) ser la temperatura del punto de congelación de la solución a\(P^{\#}\). Basamos nuestro análisis en la suposición que\(A\) obedece a la ley de Henry.
Dejamos que el disolvente sólido puro sea el estado estándar para el disolvente sólido (ver Sección 15.5). Luego, a cada temperatura,\(\mu_{B,\mathrm{solid}}={\widetilde\mu}^o_{B,\mathrm{solid}}\), y
\[\mu_{B,\mathrm{solid}}-{\widetilde\mu}^o_{B,\mathrm{solid}}=RT{ \ln {\tilde{a}}_{B,\mathrm{solid}}\ }=0\]A cada temperatura,\({\tilde{a}}_{B,\mathrm{solid}}=1\) así que eso\({\left({ \ln {\tilde{a}}_{B,\mathrm{solid}}\ }\right)}_{PT}=0\). La presión del sistema es constante en\(P^{\#}\), entonces\(dP=0\). En la expresión general
\[d\mu_{B,\mathrm{solid}}=\overline{V}_{B,\mathrm{solid}}dP-\overline{S}_{B,\mathrm{solid}}dT+RT{\left(d{ \ln {\tilde{a}}_{B,\mathrm{solid}}\ }\right)}_{PT}\]
sólo el término en\(dT\) es distinto de cero. Reconociendo que\(dT\) es el cambio en la temperatura del punto de congelación en\(P^{\#}\), para algún cambio en el potencial químico del sólido puro\(B\), tenemos
\[d\mu_{B,\mathrm{solid}}=-\overline{S}^{\textrm{⦁}}_{B,\mathrm{solid}}\ dT_{fp}\]
Dejamos que el disolvente de líquido puro a su presión de vapor de equilibrio sea el estado estándar para el disolvente en fase de solución (ver Sección 16.2). Designamos esta presión de vapor de equilibrio como\(P^{\textrm{⦁}}_B\left(T_{fp}\right)\). Ahora, ya que en última instancia encontramos\(T_{fp}<t_f\) >, el líquido puro se congela espontáneamente en\(T_{fp}\). El estado estándar para el disolvente líquido es, por lo tanto, un estado hipotético; es un líquido puro, súper enfriado. Las propiedades de este hipotético líquido pueden estimarse a partir de nuestra teoría; sin embargo, salvo posiblemente en circunstancias inusuales, no pueden medirse directamente. Ya que suponemos que el soluto obedece la ley de Henry, tenemos de la Sección 16.8 que\(d{ \ln {\tilde{a}}_{B,\mathrm{solution}}=d{ \ln y_B\ }\ }\). Así, mientras que la actividad del disolvente sólido puro es constante, la actividad del disolvente en la solución varía con la concentración de soluto. Tenemos
\[d\mu_{B,\mathrm{solution}}=-\overline{S}_{B,\mathrm{solution}}\ dT_{fp}+RT_{fp}{\left(d{ \ln y_B\ }\right)}_{PT}\]
Usando\(d{ \ln y_B\ }\approx -dy_A\), la relación\(d\mu_{B,\mathrm{solution}}=d\mu_{B,\mathrm{solid}}\) se convierte
\[-\overline{S}_{B,\mathrm{solution}}\ dT_{fp}-RT_{fp}dy_A=-\overline{S}^{\textrm{⦁}}_{B,\mathrm{solid}}\ dT_{fp}\]
o
\[dy_A=-\left(\frac{\overline{S}_{B,\mathrm{solution}}-\overline{S}^{\textrm{⦁}}_{B,\mathrm{solid}}}RT_{fp}\right)dT_{fp}\]
Consideramos sistemas en los que el punto de congelación de la solución\(T_{fp}\),, es poco diferente del punto de congelación del solvente puro,\(T_F\). Entonces,\(T_F\approx T_{fp}\), y\({T_{fp}}/{T_F}\approx 1\). Dejamos\(\left|\Delta T\right|=T_F-T_{fp}\), dónde\(\left|\Delta T\right|\ll T_F\). Dado que la solución es casi pura\(B\), la entropía molar parcial de\(B\) en la solución es aproximadamente la del líquido puro\(B\). En consecuencia, la diferencia de entropía molar parcial es, a una buena aproximación, solo la entropía de fusión del disolvente puro, en equilibrio, en el punto de congelación para la presión del sistema especificada. Es decir,
\[{\left(\overline{S}_{B,\mathrm{solution}}-\overline{S}^{\textrm{⦁}}_{B,\mathrm{solid}}\right)}_{P^{\#},T_{fp}}\approx {\left(\overline{S}^{\textrm{⦁}}_{B,\mathrm{liquid}}-\overline{S}^{\textrm{⦁}}_{B,\mathrm{solid}}\right)}_{P^{\#},T_F}=\Delta_{\mathrm{fus}}S_B={\Delta_{\mathrm{fus}}H_B}/{T_F}\]
para que\[dy_A=-\left(\frac{\Delta_{\mathrm{fus}}H_B}{RT_{fp}T_F}\right)dT_{fp}\]
En\(P^{\#}\) y\(T_F\),\(\Delta_{\mathrm{fus}}H_B\) es una constante. En la solución, la fracción molar de soluto es\(y_A\); en el disolvente sólido puro, es cero. Integrando entre los límites\(\left(0,T_F\right)\) y\(\left(y_A,T_{fp}\right)\), tenemos
\[\int^{y_A}_0{dy_A}=-\frac{\Delta_{\mathrm{fus}}H_B}{RT_F}\int^{T_{fp}}_{T_F}{\frac{dT_{fp}}{T_{fp}}}\]y\[y_A=-\frac{\Delta_{\mathrm{fus}}H_B}{RT_F}{ \ln \frac{T_{fp}}{T_F}\ }\]
Presentando\({ \ln x\approx x-1\ }\), tenemos\[y_A=-\frac{\Delta_{\mathrm{fus}}H_B}{RT_F}\left(\frac{T_{fp}}{T_F}-1\right)=\frac{\Delta_{\mathrm{fus}}H_B}{RT^2_F}\Delta T\] Resolviendo para\(\Delta T\),\[\Delta T=\left(\frac{RT^2_F}{\Delta_{\mathrm{fus}}H_B}\right)y_A\]
El proceso de fusión es endotérmico, y\(\Delta_{\mathrm{fus}}H_B>0\). Por lo tanto, encontramos\(\Delta T=T_F-T_{fp}>0\); es decir, la adición de un soluto disminuye el punto de congelación de un líquido. La depresión del punto de congelación es proporcional a la concentración de soluto.
Dado que la medición de nos\(\Delta T\) permite encontrar\(y_A\), la depresión del punto de congelación, como la elevación del punto de ebullición, nos permite determinar la masa molar de un soluto. En nuestra discusión sobre la elevación del punto de ebullición, notamos que a menudo es conveniente expresar la concentración de un soluto diluido en unidades de molalidad en lugar de fracción molar. Esto se aplica también a la depresión del punto de congelación. Asimismo, para aplicaciones prácticas, generalmente encontramos la constante de depresión del punto de congelación midiendo la depresión del punto de congelación de una solución de composición conocida.


