16.12: Propiedades coligativas - Presión Osmótica
- Page ID
- 74179
Los fenómenos de elevación del punto de ebullición y depresión del punto de congelación implican relaciones entre la composición y la temperatura de equilibrio, a presión constante del sistema. Pasamos ahora a un fenómeno, la presión osmótica, que implica una relación entre la composición y la presión de equilibrio, a temperatura constante del sistema.
Para analizar la elevación del punto de ebullición, equiparamos el potencial químico del solvente en dos subsistemas, una solución y la fase gaseosa por encima del mismo. Para analizar la depresión del punto de congelación, equiparamos el potencial químico del solvente en solución y subsistemas sólidos. De manera similar, para analizar la presión osmótica, equiparamos el potencial químico del solvente puro, a una presión, al potencial químico del solvente en una solución, a una segunda presión. Encontramos que el equilibrio sólo se puede obtener cuando la presión en el subsistema de solución excede la presión en el subsistema solvente. La diferencia entre estas dos presiones es la presión osmótica.
En los fenómenos de elevación de punto de ebullición y depresión de punto de congelación, los subsistemas están separados por un límite de fase. En el fenómeno de presión osmótica, una fase de disolvente puro se separa de una fase de solución por una membrana semipermeable. Una membrana semipermeable permite el paso libre a moléculas de solvente; sin embargo, las moléculas de soluto no pueden pasar a través de ella. En la práctica, la membrana semipermeable es un material que es penetrado por poros, o canales, cuyas dimensiones de sección transversal son casi tan pequeñas como las moléculas típicas de disolvente. Las moléculas de disolvente pueden difundirse a través de estos poros y pasar de un lado de la membrana al otro. Con tal membrana, podemos satisfacer las condiciones de presión osmótica eligiendo un soluto cuyas moléculas sean mayores que los diámetros de poro, porque las moléculas grandes no podrán pasar a través de los poros. En la práctica, el soluto en experimentos de presión osmótica es típicamente un polímero o una molécula derivada biológicamente de alto peso molecular. Las mediciones de presión osmótica han sido una fuente importante de datos sobre las masas molares de dichas sustancias.
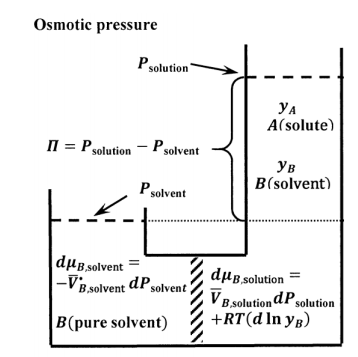
El experimento de presión osmótica se describe esquemáticamente en la Figura 9. La membrana semipermeable debe ser suficientemente robusta para soportar la caída de presión entre los dos subsistemas. A presión constante, la mezcla de los dos subsistemas es un proceso espontáneo. Si retiráramos la membrana y la caída de presión que soporta, los subsistemas se mezclarían para formar una solución única, más diluida. Por lo tanto, vemos que existe una tendencia a la migración neta de moléculas de disolvente desde el lado disolvente de la membrana hacia el lado de la solución. Podemos oponernos a esta tendencia aplicando presión adicional en el lado de la solución. Evidentemente, para cualquier composición de solución dada, habrá una presión aplicada a la que los subsistemas estén en equilibrio entre sí.
Dejamos que el disolvente de líquido puro a su presión de vapor de equilibrio sea el estado estándar tanto para el líquido puro como para el disolvente en fase de solución (ver Sección 16.2). Para que los dos subsistemas estén en equilibrio, debemos tener\({\mu }_{B,\mathrm{soluton}}={\mu }_{B,\mathrm{solvent}}\). Para cualquier cambio que lleve un estado de equilibrio a otro, tenemos\(d{\mu }_{B,\mathrm{soluton}}=d{\mu }_{B,\mathrm{solvent}}\). Dado que el subsistema de solvente puro contiene sólo\(B\), tenemos\({\tilde{a}}_{B,\mathrm{so}\mathrm{lvent}}=\mathrm{constant}\) así que\(d{ \ln {\tilde{a}}_{B,\mathrm{sol}\mathrm{vent}}\ }=0\). Ya que la temperatura es constante, tenemos\(dT=0\). Para el subsistema solvente, la expresión general de\(\ d{\mu }_{B,\mathrm{solvent}}\) reduce a
\[d{\mu }_{B,\mathrm{solvent}}={\overline{V}}^{\textrm{⦁}}_{B,\mathrm{solvent}}dP_{\mathrm{solvent}}\]
Para el subsistema de solución,\(dT=0\). Asumiendo que el solvente en la solución obedece a la ley de Raoult, tenemos\({\tilde{a}}_{B,\mathrm{sol}\mathrm{ution}}=y_B\). La ecuación general para\(d{\mu }_{B,\mathrm{soluton}}\) reduce a
\[d{\mu }_{B,\mathrm{soluton}}=\overline{V}_{B,\mathrm{solution}}dP_{\mathrm{solution}}+RT\left(d{ \ln y_B\ }\right)\]
Usando\(d{ \ln y_B\ }\approx -dy_A\), la relación\(d{\mu }_{B,\text{solution}}=d{\mu }_{B,\mathrm{solvent}}\) se convierte
\[{\overline{V}}_{B,\mathrm{solution}}dP_{\mathrm{solution}}-RTdy_A={\overline{V}}^{\textrm{⦁}}_{B,\mathrm{solvent}}dP_{\mathrm{solvent}}\]
El volumen molar de un líquido es casi independiente de la presión del sistema. Debido a que la solución es disolvente casi puro, el volumen molar de\(B\) en la solución es aproximadamente igual al volumen molar del disolvente puro\(B\). Dejando\(\overline{V}_{B,\mathrm{solution}}=\overline{V}^{\textrm{⦁}}_{B,\mathrm{solvent}}={\overline{V}}^{\textrm{⦁}}_B\), esto se convierte
\[dy_A=\left(\frac{\overline{V}^{\textrm{⦁}}_B}{RT}\right)\left(dP_{\mathrm{solution}}-dP_{\mathrm{solvent}}\right)=\left(\frac{\overline{V}^{\textrm{⦁}}_B}{RT}\right)\ d\left(P_{\mathrm{solution}}-P_{\mathrm{solvent}}\right)\]
Esta diferencia de presión es la presión osmótica; a menudo está representada por el alfabeto griego mayúscula pi:\(\mathit{\Pi}=P_{\mathrm{solution}}-P_{\mathrm{solvent}}\). La presión osmótica del disolvente puro debe ser cero; es decir,\(\mathit{\Pi}=0\) cuándo\(y_A=0\). Integrando entre los límites\(\left(0,0\right)\) y\(\left(y_A,\mathit{\Pi}\right)\), tenemos
\[\int^{y_A}_0{dy_A}=\frac{\overline{V}^{\textrm{⦁}}_B}{RT}\int^{\mathit{\Pi}}_0{d\mathit{\Pi}}\]
y
\[y_A=\frac{\overline{V}^{\textrm{⦁}}_B\mathit{\Pi}}{RT}\]
o
\[{\mathit{\Pi}\overline{V}}^{\textrm{⦁}}_B=y_ART\]
A partir de esta ecuación, vemos que la presión osmótica debe ser positiva; es decir, en equilibrio, la presión sobre la solución debe ser mayor que la presión sobre el disolvente:\(\mathit{\Pi}=P_{\mathrm{solution}}-P_{\mathrm{solvent}}>0\).
La ecuación de presión osmótica se puede poner en una forma fácilmente recordada. Para\(n_A\ll n_B\),\(y_A={n_A}/{\left(n_A+n_B\right)\approx {n_A}/{n_B}}\). Con esta sustitución,\(\mathit{\Pi}\left(n_B{\overline{V}}^{\textrm{⦁}}_B\right)=n_ART\), pero como\({\overline{V}}^{\textrm{⦁}}_B\) es el volumen molar de puro\(B\),\(V=n_B{\overline{V}}^{\textrm{⦁}}_B\) es solo el volumen del disolvente y esencialmente el mismo que el volumen de la solución. La ecuación de presión osmótica tiene la misma forma que la ecuación de gas ideal:
\[\mathit{\Pi}\left(n_B{\overline{V}}^{\textrm{⦁}}_B\right)=\mathit{\Pi}\ V=n_ART\]


