17.16: La ecuación de Nernst para medias celdas
- Page ID
- 74364
Si el S.H.E. es una de las medias celdas, la ecuación de Nernst correspondiente puede verse como una descripción de la otra media celda. Usando la celda en la que el electrodo de iones plata-plata se opone al S.H.E., como en el ejemplo anterior, el potencial celular es la suma algebraica del potencial del terminal de plata y el potencial del terminal de platino. Podemos representar el potencial del electrodo de iones plata-plata como\({\mathcal{E}}_{Ag\mid {Ag}^+}\). Dado que el S.H.E. está siempre en condiciones estándar, su potencial, que podemos representar como\({\mathcal{E}}^o_{Pt\mid H_2\mid H^+}\), es cero por definición. El potencial celular es
\[\mathcal{E}={\mathcal{E}}_{Ag\mid {Ag}^+}+{\mathcal{E}}^o_{Pt\mid H_2\mid H^+}\]
El potencial de la celda con ambas medias celdas en condiciones estándar es
\[{\mathcal{E}^o={\mathcal{E}}^o_{Ag\mid {Ag}^+}+\mathcal{E}}^o_{Pt\mid H_2\mid H^+}\]
y, nuevamente ya que el S.H.E. se encuentra en condiciones estándar,\({\tilde{a}}_{H^+}=1\) y\(P_{H_2}=1\). Sustituyendo en la ecuación de Nernst por la celda completa, tenemos
\[\mathcal{E}_{Ag\mid {Ag}^+}+ \mathcal{E}^o_{Pt\mid H_2\mid H^+}= \mathcal{E}^o_{Ag\mid Ag^+}+\mathcal{E}^o_{Pt\mid H_2\mid H^+}-\frac{RT}{\mathcal{F}} \ln \frac{1}{\tilde{a}_{Ag}^+}\]
o
\[\mathcal{E}_{Ag\mid {Ag}^+}= \mathcal{E}^o_{Ag\mid {Ag}^+}-\frac{RT}{\mathcal{F}} \ln \frac{1}{\tilde{a}_{Ag^+}}\]
donde los signos algebraicos de\(\mathcal{E}_{Ag\mid {Ag}^+}\) y\(\mathcal{E}^o_{Ag\mid {Ag}^+}\) corresponden a escribir la media reacción en la dirección\(Ag^++e^-\to Ag^0\). Obsérvese que esta es precisamente la ecuación que obtendríamos escribiendo la ecuación de Nernst correspondiente a la ecuación química\(Ag^++e^-\to Ag^0\).
Para ver cómo funcionan juntas estas diversas convenciones, consideremos la oxidación de la hidroquinona\(\left(H_2Q\right)\) a quinona\(\left(Q\right)\) por ión férrico en soluciones acuosas ácidas:
\[2\ {Fe}^{3+}+H_2Q\rightleftharpoons \ 2\ {Fe}^{2+}+Q+2H^+\]
La pareja quinona-hidroquinona es
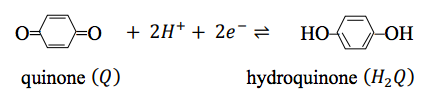
y el par de iones férrico-iones ferrosos es
\[Fe^{3+}+e^-\rightleftharpoons Fe^{2+}\]
Los potenciales de electrodo estándar son\(\mathcal{E}_{Pt\mid Q,H_2Q,H^+}=+0.699\ \mathrm{v}\) y\(\mathcal{E}_{Pt\mid Fe^{3+},Fe^{2+}}=+0.783\ \mathrm{v}\). En cada caso, el valor numérico es el potencial de una celda completa en la que el otro electrodo es el S.H.E. El signo algebraico del potencial de media celda es igual al signo del potencial eléctrico de la media celda cuando opera frente al S.H.E.
Para llevar a cabo esta reacción en una celda electroquímica, podemos usar un puente salino para unir una\(Pt\mid Fe^{3+},Fe^{2+}\) celda a una\(Pt\mid Q,H_2Q,H^+\) celda. Para construir una\(Pt\mid Fe^{3+},Fe^{2+}\) celda estándar, solo necesitamos insertar un alambre de platino en una solución que contenga iones férricos y ferrosos, ambos con actividad unitaria. Para construir una\(Pt\mid Q,H_2Q,H^+\) célula estándar, insertamos un alambre de platino en una solución que contiene quinona, hidroquinona e ión hidronio, todo con actividad unitaria. Para semiceldas estándar, las reacciones de cátodo y ánodo son
\[Fe^{3+}+e^-\rightleftharpoons Fe^{2+}\]
y
\[H_2Q\rightleftharpoons Q+2H^++2e^-\]
Podemos escribir inmediatamente la ecuación de Nernst para cada una de estas medias reacciones como
\[\mathcal{E}_{Pt\mid Fe^{3+},Fe^{2+}}=\mathcal{E}^o_{Pt\mid Fe^{3+},Fe^{2+}}-\frac{RT}{\mathcal{F}} \ln \frac{\tilde{a}_{Fe^{2+}}}{\tilde{a}_{Fe^{3+}}}\]
y
\[\left(-\mathcal{E}_{Pt\mid Q,H_2Q,H^+}\right)=\left(- \mathcal{E}^o_{Pt\mid Q,H_2Q,H^+}\right)-\frac{RT}{\mathrm{2}\mathcal{F}} \ln \frac{\tilde{a}_Q \tilde{a}^2_{H^+}}{\tilde{a}_{H_2Q}}\]
Si agregamos las ecuaciones para estas medias reacciones, el resultado no corresponde a la reacción original de celda completa, porque el número de electrones no se cancela. Esto se puede superar multiplicando la semirreacción de iones férrico-iones ferrosos por dos. ¿Qué hacemos entonces con respecto a la ecuación de Nernst de media celda correspondiente? Claramente, los valores de\({\mathcal{E}}_{Pt\mid {Fe}^{3+},{Fe}^{2+}}\) y\({\mathcal{E}}^o_{Pt\mid {Fe}^{3+},{Fe}^{2+}}\) no dependen de los coeficientes estequiométricos en la ecuación de media reacción. Sin embargo, los términos de actividad en el argumento del logaritmo lo hacen, al igual que el número de electrones que participan en la media reacción. Tenemos
\[2Fe^{3+}+2e^-\rightleftharpoons 2Fe^{2+}\]
con
\[\begin{aligned} \mathcal{E}_{Pt\mid Fe^{3+},Fe^{2+}} & = \mathcal{E}^o_{Pt\mid Fe^{3+},Fe^{2+}}-\frac{RT}{\mathrm{2}\mathcal{F}} \ln \frac{\tilde{a}^2_{Fe^{2+}}}{\tilde{a}^2_{Fe^{3+}}} \\ ~ & =\mathcal{E}^o_{Pt\mid Fe^{3+},Fe^{2+}}-\frac{RT}{\mathcal{F}} \ln \frac{\tilde{a}_{Fe^{2+}}}{\tilde{a}_{Fe^{3+}}} \end{aligned}\]
Vemos que podemos aplicar cualquier factor que nos plazca a la media reacción. La ecuación de Nernst da la misma dependencia del potencial de media célula en las concentraciones de reactivos sin importar el factor que elijamos. Esto es cierto también de la ecuación de Nernst para cualquier reacción de célula completa. En el presente ejemplo, la adición de las ecuaciones de media celda apropiadas y sus correspondientes ecuaciones de Nernst da
\[2\ Fe^{3+}+H_2Q\rightleftharpoons \ 2\ Fe^{2+}+Q+2H^+\]
y
\[ \begin{aligned} \mathcal{E} & = \mathcal{E}_{Pt\mid Fe^{3+},Fe^{2+}}- \mathcal{E}_{Pt\mid Q,H_2Q,H^+} \\ ~ & = \mathcal{E}^o_{Pt\mid Fe^{3+},Fe^{2+}}- \mathcal{E}^o_{Pt\mid Q,H_2Q,H^+}-\frac{RT}{\mathrm{2}\mathcal{F}} \ln \frac{\tilde{a}^2_{Fe^{2+}}}{\tilde{a}^2_{Fe^{3+}}} -\frac{RT}{\mathrm{2}\mathcal{F}} \ln \frac{\tilde{a}_Q \tilde{a}^2_{H^+}}{\tilde{a}_{H_2Q}} \\ ~ & =\mathcal{E}^0-\frac{RT}{\mathrm{2}\mathcal{F}} \ln \frac{\tilde{a}_Q \tilde{a}^2_{H^+} \tilde{a}^2_{Fe^{2+}}}{\tilde{a}_{H_2Q} \tilde{a}^2_{Fe^{3+}}} \end{aligned}\]


