2.5: Procesos y Caminos
- Page ID
- 77769
Un proceso es un cambio en el estado del sistema a lo largo del tiempo, comenzando con un estado inicial definido y terminando con un estado final definido. El proceso se define por una ruta, que es la secuencia continua de estados consecutivos por los que pasa el sistema, incluyendo el estado inicial, los estados intermedios y el estado final. El proceso tiene una dirección a lo largo del camino. El camino podría describirse mediante una curva en un espacio\(N\) -dimensional en el que cada eje de coordenadas representa una de las variables\(N\) independientes.
Este libro electrónico considera que un proceso termodinámico se define por lo que ocurre dentro del sistema, en la región tridimensional hasta e incluyendo el límite, y por las fuerzas ejercidas sobre el sistema por el entorno y cualquier campo externo. Las condiciones y los cambios en el entorno no forman parte del proceso salvo en la medida en que afecten a estas fuerzas. Por ejemplo, considere un proceso en el que la temperatura del sistema disminuye de\(300\K\) a\(273\K\). Podríamos lograr este cambio de temperatura colocando el sistema en contacto térmico con un baño de termostato refrigerado o una mezcla de hielo y agua. El proceso es el mismo en ambos casos, pero el entorno es diferente.
La expansión es un proceso en el que el volumen del sistema aumenta; en compresión, el volumen disminuye.
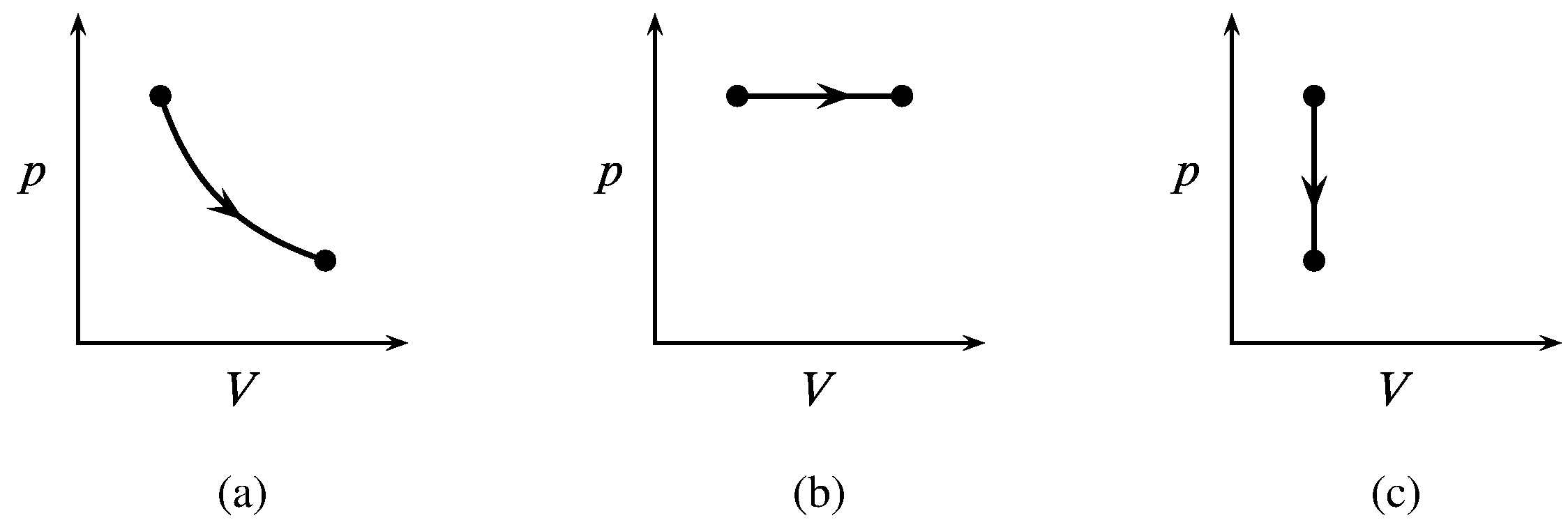
Figura 2.9 Trayectorias de tres procesos de un sistema cerrado de gas ideal con\(p\) y\(V\) como variables independientes. a) Expansión isotérmica. b) Expansión isobárica. c) Reducción de la presión isocórica.
Las trayectorias para estos procesos de un gas ideal se muestran en la Fig. 2.9. Un proceso isotérmico es aquel en el que la temperatura del sistema permanece uniforme y constante. Un proceso isobárico o isopiéstico se refiere a una presión constante uniforme, y un proceso isocórico se refiere al volumen constante.
Un proceso adiabático es aquel en el que no hay transferencia de calor a través de ninguna porción del límite. Podemos asegurar que un proceso sea adiabático ya sea usando un límite adiabático o, si el límite es diatérmico, ajustando continuamente la temperatura externa para eliminar un gradiente de temperatura en el límite.
Recordemos que una función de estado es una propiedad cuyo valor en cada instante depende únicamente del estado del sistema en ese instante. Se escribe el cambio finito de una función de estado\(X\) en un proceso\(\Del X\). La notación\(\Del X\) siempre tiene el significado\(X_2 - X_1\), donde\(X_1\) está el valor en el estado inicial y\(X_2\) es el valor en el estado final. Por lo tanto, el valor de\(\Del X\) depende únicamente de los valores de\(X_1\) y\(X_2\). El cambio de una función de estado durante un proceso depende únicamente de los estados inicial y final del sistema, no de la trayectoria del proceso.
Se escribe un cambio infinitesimal de la\(X\) función estatal\(\dif X\). La operación matemática de sumar un número infinito de cambios infinitesimales es la integración, y la suma es una integral (véase la breve revisión del cálculo en el Apéndice E). La suma de los cambios infinitesimales\(X\) a lo largo de un camino es una integral definida igual a\(\Del X\):\ begin {ecuación}\ int_ {X_1} ^ {X_2}\! \ dif X = X_2-X_1 =\ Delta X\ tag {2.5.1}\ end {ecuación} Si\(\dif X\) obedece a esta relación, es decir, si su integral para límites dados tiene el mismo valor independientemente de la ruta, se llama diferencial exacto. El diferencial de una función de estado es siempre un diferencial exacto.
Un proceso cíclico es un proceso en el que el estado del sistema cambia y luego vuelve al estado inicial. En este caso la integral de\(\dif X\) se escribe con un signo integral cíclico:\(\oint \dif X\). Dado que una función de estado\(X\) tiene los mismos valores iniciales y finales en un proceso cíclico,\(X_2\) es igual a\(X_1\) y la integral cíclica de\(\dif X\) es cero:\ begin {ecuación}\ oint\ dif X = 0\ tag {2.5.2}\ end {ecuación}
Heat (\(q\)) y work (\(w\)) son ejemplos de cantidades que no son funciones de estado. Ni siquiera son propiedades del sistema; en cambio, son cantidades de energía transferidas a través de la frontera a lo largo de un periodo de tiempo. Por lo tanto, sería incorrecto escribir “\(\Del q\)” o “”\(\Del w\). En cambio, los valores de\(q\) y\(w\) dependen en general de la ruta y se denominan funciones de ruta.
Este libro electrónico utiliza el símbolo\(\dBar\) (la letra “d” con una barra a través del tallo) para una cantidad infinitesimal de una función de ruta. Así,\(\dq\) y\(\dw\) son infinitesimales cantidades de calor y trabajo. La suma de muchas cantidades infinitesimales de una función path no es la diferencia de dos valores de la función path; en cambio, la suma es la cantidad neta:\ begin {equation}\ int\! \ dq = q\ qquad\ int\! \ dw = w\ tag {2.5.3}\ end {ecuación} Las cantidades infinitesimales\(\dq\) y\(\dw\), debido a que los valores de sus integrales dependen de la ruta, son diferenciales inexactos.Los termodinámicos químicos suelen escribir estas cantidades como\(\dif q\) y\(\dif w\). Los matemáticos, sin embargo, fruncen el ceño al usar la misma notación para diferenciales inexactos y exactos. Otras notaciones que a veces se utilizan para indicar que el calor y el trabajo son funciones de ruta son\(\tx{D}q\) y\(\tx{D}w\), y también\(\delta q\) y\(\delta w\).
Existe una diferencia fundamental entre una función de estado (como temperatura o volumen) y una función de ruta (como calor o trabajo): El valor de una función de estado se refiere a un instante de tiempo; el valor de una función de ruta se refiere a un intervalo de tiempo.
La diferencia entre una función de estado y una función de ruta en la termodinámica es análoga a la diferencia entre la elevación y la longitud del sendero en la escalada de una montaña. Supongamos que un comienzo de sendero en la base de la montaña tiene varios senderos hasta la cima. El excursionista en cada instante se encuentra a una elevación definida sobre el nivel del mar. Durante una subida desde el comienzo del sendero hasta la cima, el cambio de elevación del excursionista es independiente del sendero utilizado, pero la longitud del sendero desde la base hasta la cima depende del sendero.


