4.9: Capítulo 4 Problemas
- Page ID
- 78026
Un número de problema subrayado o letra de parte del problema indica que la respuesta numérica aparece en el Apéndice I.
4.1 Explique por qué un refrigerador eléctrico, que transfiere energía por medio del calor del compartimiento de almacenamiento de alimentos fríos al aire más cálido de la habitación, no es un imposible “Clausius dispositivo.”
4.2 Un sistema que consiste en una cantidad fija de un gas ideal se mantiene en equilibrio térmico con un depósito de calor a temperatura\(T\). El sistema se somete al siguiente ciclo isotérmico:
1. El gas, inicialmente en estado de equilibrio con volumen\(V_{0}\), se le permite expandirse al vacío y alcanzar un nuevo estado de equilibrio de volumen\(V^{\prime}\).
2. El gas se comprime reversiblemente de\(V^{\prime}\) a\(V_{0}\).
Para este ciclo, busque expresiones o valores para\(w, \oint \mathrm{d} q / T\), y\(\oint \mathrm{d} S .\)
4.3 En un proceso isotérmico irreversible de un sistema cerrado:
a) ¿Es posible\(\Delta S\) que sea negativo?
b) ¿Es posible que\(\Delta S\) sea menor que\(q / T\)?
4.4 Supongamos que tiene dos bloques de cobre, cada uno de capacidad calorífica\(C_{V}=200.0 \mathrm{JK}^{-1}\). Inicialmente un bloque tiene una temperatura uniforme de\(300.00 \mathrm{~K}\) y el otro\(310.00 \mathrm{~K}\). Calcula el cambio de entropía que se produce cuando colocas los dos bloques en contacto térmico entre sí y los rodeas con un aislamiento térmico perfecto. ¿El signo de\(\Delta S\) concuerda con la segunda ley? (Supongamos que el proceso ocurre a volumen constante.)
4.5 Consulte el aparato mostrado en las Figs. \(3.23\)en la página 101 y\(3.26\) en la página 103 y descrita en Probes. \(3.3\)y 3.8. Para ambos sistemas, evalúe\(\Delta S\) el proceso que resulta de abrir la llave de paso. También evalúe\(\int \mathrm{d} q / T_{\text {ext }}\) para ambos procesos (para el aparato de la Fig. 3.26, supongamos que los vasos tienen paredes adiabáticas). ¿Sus resultados son consistentes con el enunciado matemático de la segunda ley?
Figura 4.13
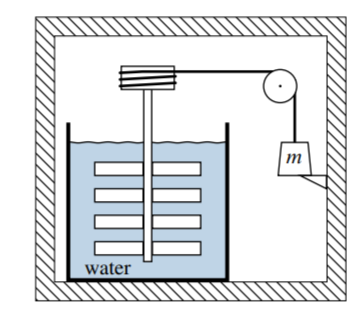
4.6 La figura\(4.13\) muestra las paredes de una caja rígida térmicamente aislada (rayado cruzado). El sistema es el contenido de esta caja. En la caja se encuentra una rueda de paletas sumergida en un recipiente de agua, conectada por un cordón y una polea a un peso de masa\(m\). El peso descansa sobre un tope ubicado a una distancia\(h\) por encima del fondo de la caja. Supongamos que la capacidad calorífica del sistema,\(C_{V}\), es independiente de la temperatura. Inicialmente el sistema se encuentra en un estado de equilibrio a temperatura\(T_{1}\).
Cuando se retira el tope, el peso se hunde irreversiblemente hasta el fondo de la caja, haciendo que la rueda de paletas gire en el agua. Eventualmente el sistema alcanza un estado de equilibrio final con equilibrio térmico. Describir un proceso reversible con el mismo cambio de entropía que este proceso irreversible, y derivar una fórmula para\(\Delta S\) en términos de\(m, h, C_{V}\), y\(T_{1}\).


