13.4: Capítulo 13 Problemas
- Page ID
- 78017
Un número de problema subrayado o una letra de parte del problema indica que la respuesta numérica aparece en el Apéndice I.
13.1 Considerar un sistema monofásico que sea una mezcla gaseosa de\(\mathrm{N}_{2}, \mathrm{H}_{2}\), y\(\mathrm{NH}_{3}\). Para cada uno de los siguientes casos, busque el número de grados de libertad y dé un ejemplo de las variables intensivas independientes que podrían utilizarse para especificar el estado de equilibrio, aparte de la cantidad total de gas.
a) No hay reacción.
b) La reacción\(\mathrm{N}_{2}(\mathrm{~g})+3 \mathrm{H}_{2}(\mathrm{~g}) \rightarrow 2 \mathrm{NH}_{3}(\mathrm{~g})\) se encuentra en equilibrio.
(c) La reacción está en equilibrio y el sistema se prepara\(\mathrm{NH}_{3}\) únicamente a partir de.
13.2 ¿Cuántos componentes tiene una mezcla de agua y óxido de deuterio en la que existe el equilibrio\(\mathrm{H}_{2} \mathrm{O}+\mathrm{D}_{2} \mathrm{O} \rightleftharpoons 2\) HDO?
13.3 Considerar un sistema que contenga solamente\(\mathrm{NH}_{4} \mathrm{Cl}(\mathrm{s}), \mathrm{NH}_{3}(\mathrm{~g})\), y\(\mathrm{HCl}(\mathrm{g}) .\) Supongamos que\(\mathrm{NH}_{4} \mathrm{Cl}(\mathrm{s}) \rightleftharpoons \mathrm{NH}_{3}(\mathrm{~g})+\mathrm{HCl}(\mathrm{g})\) existe el equilibrio.
(a) Supongamos que prepara el sistema colocando sólidos\(\mathrm{NH}_{4} \mathrm{Cl}\) en un matraz evacuado y calentando a\(400 \mathrm{~K}\). Usa la regla de fase para decidir si puedes variar la presión mientras ambas fases permanecen en equilibrio en\(400 \mathrm{~K}\).
(b) De acuerdo con la regla de fases, si el sistema no se prepara como se describe en la parte (a) ¿podría variar la presión mientras ambas fases permanezcan en equilibrio en\(400 \mathrm{~K}\)? Explique.
(c) Racionalizar sus conclusiones para estos dos casos sobre la base de la constante de equilibrio termodinámico. Supongamos que la fase gaseosa es una mezcla de gases ideal y usa la expresión aproximada\(K=p_{\mathrm{NH}_{3}} p_{\mathrm{HCl}} /\left(p^{\circ}\right)^{2}\).
13.4 Considerar el proceso del horno de cal\(\mathrm{CaCO}_{3}(\mathrm{~s}) \rightarrow \mathrm{CaO}(\mathrm{s})+\mathrm{CO}_{2}(\mathrm{~g})\). Encuentra el número de variables intensivas que se pueden variar independientemente en el sistema de equilibrio bajo las siguientes condiciones:
a) El sistema se prepara colocando carbonato de calcio, óxido de calcio y dióxido de carbono en un recipiente.
b) El sistema se prepara únicamente a partir de carbonato de calcio.
(c) La temperatura se fija en\(1000 \mathrm{~K}\).
13.5 ¿Cuáles son los valores de\(C\) y\(F\) en los sistemas consistentes\(\mathrm{AgCl}\) en sólidos en equilibrio con una fase acuosa que contienen\(\mathrm{H}_{2} \mathrm{O}, \mathrm{Ag}^{+}(\mathrm{aq}), \mathrm{Cl}^{-}(\mathrm{aq}), \mathrm{Na}^{+}(\mathrm{aq})\), y\(\mathrm{NO}_{3}^{-}(\mathrm{aq})\) se preparan de las siguientes maneras? Dar ejemplos de variables intensivas que podrían variarse de forma independiente.
(a) El sistema se prepara equilibrando el exceso de sólido\(\mathrm{AgCl}\) con una solución acuosa de\(\mathrm{NaNO}_{3}\).
b) El sistema se prepara mezclando soluciones acuosas de\(\mathrm{AgNO}_{3}\) y\(\mathrm{NaCl}\) en proporciones arbitrarias; algunas\(\mathrm{AgCl}\) formas sólidas por precipitación.
13.6 ¿Cuántos grados de libertad tiene un sistema consistente\(\mathrm{NaCl}\) en sólido en equilibrio con una fase acuosa que contiene\(\mathrm{H}_{2} \mathrm{O}, \mathrm{Na}^{+}(\mathrm{aq}), \mathrm{Cl}^{-}(\mathrm{aq}), \mathrm{H}^{+}(\mathrm{aq})\), y\(\mathrm{OH}^{-}(\mathrm{aq})\)? ¿Sería posible variar independientemente\(T, p\), y\(m_{\mathrm{OH}^{-}}\)? Si es así, explica cómo podrías hacer esto.
13.7 Consulte el diagrama de fases que se muestra en la Fig. \(13.4\)en la página 430. Supongamos que el sistema contiene\(36.0 \mathrm{~g}\) (2.00 mol)\(\mathrm{H}_{2} \mathrm{O}\) y\(58.4 \mathrm{~g}\) (1.00 mol)\(\mathrm{NaCl}\) a\(25^{\circ} \mathrm{C}\) y 1 bar.
a) Describir las fases presentes en el sistema de equilibrio y sus masas.
(b) Describir los cambios que ocurren a presión constante si el sistema se coloca en contacto térmico con un reservorio de calor en\(-30^{\circ} \mathrm{C}\).
(c) Describir los cambios que se producen si la temperatura se eleva de\(25^{\circ} \mathrm{C}\) a\(120^{\circ} \mathrm{C}\) a presión constante.
(d) Describir el sistema después de\(200 \mathrm{~g} \mathrm{H}_{2} \mathrm{O}\) que se agregue en\(25^{\circ} \mathrm{C}\).
Cuadro 13.1 Solubilidades acuosas de sulfato de sodio decahidratado y sulfato de sodio anhidro\({ }^{a}\)
\ begin {tabular} {lccc}
\ hline\(\mathrm{Na}_{2} \mathrm{SO}_{4} \cdot 10 \mathrm{H}_{2} \mathrm{O}\) & &\ multicolumna {2} {c} {\(\mathrm{Na}_{2} \mathrm{SO}_{4}\)}\\
\ cline {1 - 2}\ cline {5}\(t /{ }^{\circ} \mathrm{C}\) & &\(x_{\mathrm{B}}\)\(t /{ }^{\circ} \mathrm{C}\) &\(x_{\mathrm{B}}\)\\
\ hline 10 & &\(0.011\) & 40 &\(0.058\)\\
15 & ;\(0.016\) & 50 &\(0.056\)\\
20 &\(0.024\) & &\\
25 &\(0.034\) & & &\\
30\(0.048\) & & &\
\\ hline\({ }^{a}\) Ref. [59], p. 179-180. & &\\
& & &
\ fin {tabular}
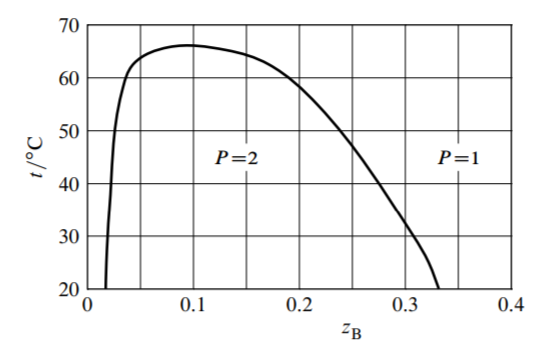
13.8 Utilice la siguiente información para dibujar un diagrama de fases de temperatura-composición para el sistema binario de\(\mathrm{H}_{2} \mathrm{O}(\mathrm{A})\) y\(\mathrm{Na}_{2} \mathrm{SO}_{4}(\mathrm{~B})\) en\(p=1\) bar, confinándose\(t\) al rango\(-20\)\(z_{\mathrm{B}}\) hasta\(50^{\circ} \mathrm{C}\) y al rango\(0-0.2\). El decahidrato sólido,\(\mathrm{Na}_{2} \mathrm{SO}_{4} \cdot 10 \mathrm{H}_{2} \mathrm{O}\), es estable por debajo\(32.4^{\circ} \mathrm{C}\). La sal anhidra,\(\mathrm{Na}_{2} \mathrm{SO}_{4}\), es estable por encima de esta temperatura. Hay un punto peritéctico para estos dos sólidos y la solución en\(x_{\mathrm{B}}=0.059\) y\(t=32.4^{\circ} \mathrm{C}\). Hay un punto eutéctico para el hielo,\(\mathrm{Na}_{2} \mathrm{SO}_{4} \cdot 10 \mathrm{H}_{2} \mathrm{O}\), y la solución en\(x_{\mathrm{B}}=0.006\) y\(t=-1.3^{\circ} \mathrm{C}\). Tabla\(13.1\) da la dependencia de temperatura de las solubilidades de los sólidos iónicos.
Cuadro 13.2 Datos para el Problema 13.9. Temperaturas de soluciones saturadas de cloruro acuoso de hierro (III) a\(p=\) 1 bar (\ left (\ mathrm {A} =\ mathrm {FeCl} _ {3},\ mathrm {~B} =\ mathrm {H} _ _ {2}\ mathrm {O}\ right) ^ {a}\)
\ begin {tabular} {crcccr}
\ hline\(x_{\mathrm{A}}\) &\(t /{ }^{\circ} \mathrm{C}\) & &\(x_{\mathrm{A}}\) &\(t /{ }^{\circ} \mathrm{C}\) &\(x_{\mathrm{A}}\) &\(t /{ }^{\circ} \mathrm{C}\)\
\ hline\(0.000\) & &\(0.0\) &\(0.119\) &\(35.0\) &\(0.286\) & &\(56.0\)\
\(0.020\) & \(-10.0\)& & &\(0.143\) &\(37.0\) &\(0.289\) &\(55.0\) & &
\(0.032\) &\(-20.5\) & &\(0.157\) &\(36.0\) &\(0.293\) &\(60.0\) & &
\(0.037\) &\(-27.5\) &\(0.173\) &\(33.0\) & ;\(0.301\) &\(69.0\)\\
\(0.045\) & &\(-40.0\) &\(0.183\) &\(30.0\) &\(0.318\) &\(72.5\)\\
\(0.052\) &\(-55.0\) & &\(0.195\) &\(27.4\) &\(0.333\) &\(73.5\)\\
\(0.053\)&\(-41.0\) &\(0.213\) &\(32.0\) &\(0.343\) &\(72.5\) & &
\(0.056\) & &\(-27.0\) &\(0.222\) &\(32.5\) &\(0.358\) &\(70.0\) & &
\(0.076\) &\(0.0\) &\(0.232\) & \(30.0\)&\(0.369\) &\(66.0\) & &
\(0.083\) &\(10.0\) &\(0.238\) &\(35.0\)\(0.369\) &\(80.0\) & &
\(0.093\) &\(20.0\) &\(0.259\) &\(50.0\) &\(0.373\) &\(100.0\) & &
\(0.106\)&\(30.0\) &\(0.277\) &\(55.0\) & &\
\ hline
\ end {tabular}
\({ }^{a}\) Datos de Ref. [59], página\(193 .\)
13.9 El cloruro de hierro (III) forma diversos hidratos sólidos, todos los cuales se funden congruentemente. El cuadro de la\(13.2\) página anterior enumera las temperaturas\(t\) de soluciones acuosas de diversas composiciones que están saturadas con respecto a una fase sólida.
(a) Utilizar estos datos para construir un diagrama de\(t-z_{\mathrm{B}}\) fases para el sistema binario de\(\mathrm{FeCl}_{3}\) (A) y\(\mathrm{H}_{2} \mathrm{O}\) (B). Identificar la fórmula y punto de fusión de cada hidrato. Pista: derivar una fórmula para la relación\(n_{\mathrm{B}} / n_{\mathrm{A}}\) molar en función de\(x_{\mathrm{A}}\) en una mezcla binaria.
b) Para las siguientes condiciones, determinar la fase o fases presentes en equilibrio y la composición de cada una.
1. \(t=-70.0^{\circ} \mathrm{C}\)y\(z_{\mathrm{A}}=0.100\)
2. \(t=50.0^{\circ} \mathrm{C}\)y\(z_{\mathrm{A}}=0.275\)
\(\overlineCallstack:
at (Quimica/Química_Física_y_Teórica/Libro:_Termodinámica_y_Química_(DeVOe)/13:_La_regla_de_fase_y_los_diagramas_de_fase/13.04:_Capítulo_13_Problemas), /content/body/p[31]/span[1]/span, line 1, column 2
13.10 La Figura\(13.19\) es un diagrama de fases de temperatura-composición para el sistema binario de agua (A) y fenol (B) a 1 bar. Estos líquidos son parcialmente miscibles a continuación\(67^{\circ} \mathrm{C}\). El fenol es más denso que el agua, por lo que la capa con la mayor fracción molar de fenol es la capa inferior. Supongamos que coloca\(4.0 \mathrm{~mol}\) de\(\mathrm{H}_{2} \mathrm{O}\) y\(1.0 \mathrm{~mol}\) de fenol en un vaso de precipitados\(30^{\circ} \mathrm{C}\) y revuelve suavemente para permitir que las capas se equilibre.
a) ¿Cuáles son las composiciones de las capas superior e inferior equilibradas?
(b) Encuentra la cantidad de cada componente en la capa inferior.
(c) A medida que poco a poco se agita más fenol en el vaso de precipitados, manteniendo la temperatura en\(30^{\circ} \mathrm{C}\), ¿qué cambios ocurren en los volúmenes y composiciones de las dos capas? Suponiendo que una capa finalmente desaparece, ¿qué cantidad adicional de fenol se necesita para hacer que esto suceda?
13.11 El punto de ebullición estándar del propano es\(-41.8{ }^{\circ} \mathrm{C}\) y el de\(n\) -butano es\(-0.2{ }^{\circ} \mathrm{C}\). \(13.3\)En la tabla de la siguiente página se enumeran los datos de presión de vapor para los líquidos puros. Supongamos que las mezclas líquidas obedecen a la ley de Raoult.
a) Calcular las composiciones,\(x_{\mathrm{A}}\), de las mezclas líquidas con puntos de ebullición de\(-10.0^{\circ} \mathrm{C}\)\(-20.0^{\circ} \mathrm{C}\), y\(-30.0^{\circ} \mathrm{C}\) a una presión de\(1 \mathrm{bar}\).
(b) Calcular las composiciones\(y_{\mathrm{A}}\),, del vapor de equilibrio a estas tres temperaturas.
Tabla\(13.3\) Presión de vapor de saturación de propano (A) y\(n\) -butano (B)
\ begin {tabular} {ccc}
\ hline\(t /{ }^{\circ} \mathrm{C}\) &\(p_{\mathrm{A}}^{*} /\) bar &\(p_{\mathrm{B}}^{*} / \mathrm{bar}\)\\
\ hline\(-10.0\) &\(3.360\) &\(0.678\)\\\
\(-20.0\) &\(2.380\) & &\(0.441\)\\
\(-30.0\)\(1.633\) & &\(0.275\)\
\ hline
\ final {tabular}
(c) Trazar el diagrama de fases de temperatura-composición en\(p=1\) barra usando estos datos, y etiquetar las áreas de manera apropiada.
(d) Supongamos que un sistema que contiene\(10.0 \mathrm{~mol}\) propano y\(10.0 \mathrm{~mol} n\) -butano se lleva a una presión de 1 bar y una temperatura de\(-25^{\circ} \mathrm{C}\). A partir de su diagrama de fases, estime las composiciones y cantidades de ambas fases.
Cuadro 13.4 Composiciones líquidas y gaseosas en el sistema bifásico de 2-propanol (A) y benceno a\(45^{\circ} \mathrm{C}^{a}\)
\ begin {tabular} {llcccc}
\ hline\(x_{\mathrm{A}}\) &\(y_{\mathrm{A}}\) &\(p / \mathrm{kPa}\) &\(x_{\mathrm{A}}\) &\(y_{\mathrm{A}}\) &\(p / \mathrm{kPa}\)\
\ hline 0 & 0 & &\(29.89\) &\(0.5504\) &\(0.3692\) & &
\(0.0472\) &\(35.32\)\\(0.1467\) & \(33.66\)&\(0.6198\) &\(0.3951\) & &\(34.58\) & &
\(0.0980\) &\(0.2066\) &\(35.21\) & &\(0.7096\) &\(0.4378\) &\(33.02\) & &
\(0.2047\) &\(0.2663\) & &\(36.27\) &\(0.8073\) &\(0.5107\) & \(30.28\)\\
\(0.2960\) & &\(0.2953\) &\(36.45\) & &\(0.9120\) &\(0.6658\) & & &\(25.24\)
\(0.3862\) & &\(0.3211\) &\(36.29\) & &\(0.9655\) &\(0.8252\) & & &\(21.30\)
\(0.4753\) & & \(0.3463\)&\(35.93\) &\(1.0000\) &\(1.0000\) &\(18.14\)\
\ hline
\ end {tabular}
\({ }^{a}\) Ref. [24].
13.12 Utilice los datos de la Tabla\(13.4\) para dibujar un diagrama de fases presión-composición para el sistema 2-propanolbenceno en\(45^{\circ} \mathrm{C}\). Etiquete los ejes y cada área.
Cuadro 13.5 Composiciones líquidas y gaseosas en el sistema bifásico de acetona (A) y cloroformo a\(35.2{ }^{\circ} \mathrm{C}\)
\ begin {tabular} {lllccc}
\ hline\(x_{\mathrm{A}}\) &\(y_{\mathrm{A}}\) &\(p / \mathrm{kPa}\) &\(x_{\mathrm{A}}\) &\(y_{\mathrm{A}}\) &\(p / \mathrm{kPa}\)\
\ hline 0 & 0 & &\(39.08\) &\(0.634\) &\(0.727\) & &
\(0.083\) &\(36.29\)\\(0.046\) & \(37.34\)&\(0.703\) &\(0.806\) & &\(38.09\) & &
\(0.200\) &\(0.143\) &\(34.92\) & &\(0.815\) &\(0.896\) &\(40.97\) & &
\(0.337\) &\(0.317\) & &\(33.22\) &\(0.877\) &\(0.936\) & \(42.62\)\\
\(0.413\) & &\(0.437\) &\(33.12\) & &\(0.941\) &\(0.972\) & & &\(44.32\)
\(0.486\) & &\(0.534\) &\(33.70\) & &\(1.000\) &\(1.000\) & & &\(45.93\)
\(0.577\) & & \(0.662\)&\(35.09\) & & &\
\ hline
\ end {tabular}
\({ }^{a}\) Ref. [179], p.\(286 .\)


