4.4: La Base Electrónica de la Tabla Periódica
- Page ID
- 69376
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Los orbitales similares a hidrógeno para un átomo de muchos electrones se enumeran en orden de energía creciente en la Fig. 4-2. Este diagrama de nivel de energía difiere del diagrama correspondiente para el átomo de hidrógeno, un sistema de un electrón. En el átomo de muchos electrones todos los orbitales con el mismo valor del número cuántico principal n no tienen la misma energía que en el caso del hidrógeno. Para los muchos átomos de electrones, la energía de un orbital depende tanto de n como de l, la energía aumenta a medida que l aumenta incluso cuando n es constante. Por ejemplo, a partir de la Fig. 4-2 es evidente que el orbital de 3 d posee una energía mayor que la orbital de 3 p que a su vez tiene una energía mayor que la orbital de 3 p. El motivo de esta diferencia entre el caso de uno y el de muchos electrones se discutirá a continuación. La energía de la órbita sigue siendo independiente del número cuántico magnético m. Así, cuando l = 1, hay tres orbitales p que aún están degenerados (todos poseen la misma energía) y esto se indica por los tres círculos abiertos que se superponen en cada uno de los niveles p. Los círculos abiertos representan así el número de orbitales disponibles o la degeneración de cada nivel de energía orbital.
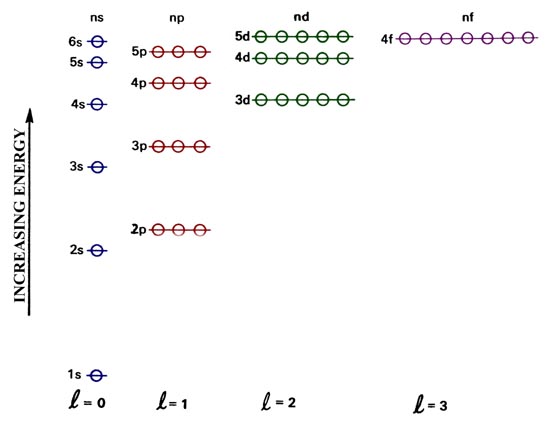
Fig. 4.2. Un diagrama orbital de nivel de energía para un átomo de muchos electrones.
Con la ayuda de este esquema de nivel energético y del principio Pauli podemos proceder a construir las estructuras electrónicas de todos los átomos. Esto lo hacemos asignando electrones uno a la vez al orbital vacante que posee la energía más baja. Un orbital se “llena” cuando contiene dos electrones con sus espines emparejados.
Hidrógeno. La carga nuclear es 1 y el electrón único se coloca en el orbital de 1 s. La configuración electrónica es 1 s 1.
Helio. La carga nuclear se incrementa en una unidad a 2 y el electrón extra se coloca nuevamente en el orbital de 1 s, con su espín opuesto al del electrón ya presente. La configuración electrónica es de 1 s 2.
Litio. La carga nuclear es 3 y el tercer electrón, por el principio Pauli, debe colocarse en el orbital 2s ya que el orbital 1s está doblemente ocupado. La configuración electrónica del litio es por lo tanto 1 s 2 2 s 1.
Ahora podemos responder a la pregunta de por qué el orbital 2 s es más estable que el orbital 2 p, es decir, por qué Li se describe como 1 s 2 2 s 1 y no como 1 s 2 2 p 1. Los dos electrones internos de litio (aquellos en el orbital de 1 s) blindan parcialmente la carga nuclear del elctrón externo. Recordemos que a medida que n aumenta, la distancia promedio entre el electrón y el núcleo aumenta. Así, la mayor parte de la densidad de electrones del electrón con n = 2 estará fuera de la densidad de carga de los dos electrones internos que tienen n = 1. Cuando el electrón externo está a grandes distancias del núcleo y por lo tanto esencialmente fuera de la capa interna de densidad electrónica experimentará una fuerza de solo una de las tres cargas positivas en el núcleo de litio. Sin embargo, como el electrón externo tiene una probabilidad pequeña pero finita de estar cerca del núcleo, penetrará en cierta medida la densidad de electrones estrechamente ligados de los dos electrones de 1 s. Al hacerlo “verá” mucho más de la carga nuclear total y estará más atado. Cuanto más cerca pueda llegar el electrón externo al núcleo, es decir, cuanto más pueda penetrar en la distribución de densidad de los electrones de la capa interna, más estrechamente ligado estará.
Un electrón en un orbital s tiene una probabilidad finita de ser encontrado justo en el núcleo. Un electrón en un orbital p por otro lado tiene un nodo en su distribución de densidad en el núcleo. Así, un electrón s penetra en la densidad de la capa interna de manera más efectiva que un electrón p y, en consecuencia, está más estrechamente unido al átomo. En un átomo de hidrógeno, no hay electrones internos y tanto un electrón de 2 s como de 2 p siempre experimentan la carga nuclear completa y tienen la misma energía. El quid de este efecto de penetración en la energía es que la densidad electrónica de la capa interna posee una extensión finita en el espacio. Así, un electrón externo puede penetrar la densidad de la cubierta interna y se reduce el efecto de cribado. Si la densidad de la capa interna se contrajo directamente sobre el núcleo, entonces no importa cuán cerca llegara el electrón externo al núcleo de litio, siempre experimentaría solo una carga de +1. Esta dependencia de las energías orbitales en su valor l se llama acertadamente el efecto de penetración.
La densidad electrónica de un electrón d se concentra aún más lejos del núcleo que la de un electrón p. En consecuencia, la energía orbital de un electrón d es incluso menos estable que la de un electrón p. En algunos átomos la penetración de la densidad de la capa interna por un electrón d es tan leve que su energía se eleva incluso sobre la del electrón s con el siguiente valor n más alto. Por ejemplo, un electrón de 3 d posee una energía mayor que un electrón de 4 s en los átomos Sc a Zn con las excepciones de Cr y Cu. El efecto de penetración en estos elementos anula el número cuántico principal para d electrones en la determinación de sus energías relativas.
Observe que la configuración 1 s 2 2 s 1 para litio supera las dificultades de nuestros intentos anteriores de describir la estructura electrónica de este átomo. El principio Pauli, del que fuimos ignorantes en nuestro intento anterior, obliga al tercer electrón a ocupar el orbital de 2 s y obliga a su vez al inicio de una nueva concha cuántica, es decir, un nuevo valor de n. Así, el litio, al igual que el hidrógeno, posee un electrón externo en un orbital s. Ya que es solo la densidad electrónica externa la que en general está involucrada en un cambio químico, el litio y el hidrógeno deben tener algunas propiedades químicas en común, como efectivamente lo hacen. El hidrógeno es el inicio del primer periodo (n = 1) y el litio marca el inicio del segundo periodo (n = 2).
Berilio. La carga nuclear es 4 y la configuración electrónica es 1 s 2 2 s 2.
Boro. Z = 5 y la configuración electrónica es de 1 s 2 2 s 2 2 p 1.
Carbono. Z = 6. La colocación del sexto electrón de carbono requiere algún comentario. Obviamente entrará en un orbital de 2 p. Pero ¿en cuál de los tres debería colocarse? ¿Debería colocarse en el orbital 2 p que ya posee un electrón, o debería colocarse en uno de los orbitales 2 p vacantes? Si se coloca en el orbital ocupado de 2 p su espín debe emparejarse con el del electrón ya presente y el resultado sería un átomo de carbono no magnético. Sin embargo, si se coloca en uno de los orbitales vacantes de 2 p se le puede asignar un espín paralelo al primer electrón. La cuestión se decide sobre la base de qué situación da la energía más baja. Como resultado del principio Pauli, dos electrones con espines paralelos (ambos hacia arriba o ambos hacia abajo) tienen sólo una probabilidad muy pequeña de estar cerca el uno del otro. De hecho, la función de onda que describe el caso de dos electrones para los espines paralelos desaparece cuando ambos electrones se acercan entre sí. Cuando la función de onda desaparece, la distribución de probabilidad correspondiente va a cero. En promedio, entonces, los electrones con espines paralelos tienden a mantenerse alejados unos de otros. El principio Pauli no impide que dos electrones con espines emparejados, ya sea en el mismo o en diferentes orbitales, estén cerca uno del otro. ¡La función de onda para esta situación es finita incluso cuando están una encima de la otra! Obviamente, dos electrones con espines paralelos tendrán un valor menor para la energía electrostática de repulsión entre ellos que dos electrones con espines emparejados. Este es un resultado general que se mantiene casi sin excepción en la aproximación orbital. Se le conoce como una de las reglas de Hund ya que fue el primero en declararlo. Así, la configuración electrónica más estable del átomo de carbono es 1 s 2 2 s 2 p 2 () donde hemos enfatizado el hecho de que los dos 2 p los electrones tienen espines paralelos y por lo tanto deben estar en diferentes orbitales de 2 p.
Nitrógeno. Z = 7. Debido a la regla de Hund, la configuración electrónica es
es decir, un electrón en cada uno de los orbitales de 2 p. La configuración con el mayor componente posible del momento magnético de giro será la más estable.
Oxígeno. Z = 8. Uno de los 2 electrones p ahora debe estar emparejado con el electrón agregado, pero los otros 2 electrones p quedarán desapareados.
(Solo el número de electrones desapareados se indica con las flechas).
Flúor. Z = 9. La configuración será
Neón. Z = 10. El décimo electrón ocupará la última vacante restante en la segunda capa cuántica (el conjunto de orbitales con n = 2).
Así, el neón representa el final del segundo periodo y todos los electrones tienen espines emparejados.
Cuando todos los orbitales de un proyectil dado están doblemente ocupados, la configuración resultante se denomina “caparazón cerrado”. El helio y el neón son similares en que ambos poseen configuraciones de caparazón cerrado. Debido a que ninguno de estos elementos posee una vacante en su capa exterior de orbitales ambos están dotados de propiedades químicas similares. Cuando los orbitales que pertenecen a un valor l dado contienen un electrón cada uno (están medio llenos) o están completamente llenos, la distribución de densidad resultante es de forma esférica. Así, las distribuciones de densidad electrónica de nitrógeno y neón, por ejemplo, serán esféricas.
La referencia a la Fig. 4-2 indica que el siguiente elemento, el sodio, tendrá su electrón externo colocado en la órbita de 3 s y será el primer elemento en el tercer periodo. Dado que su estructura electrónica externa es similar a la de los elementos anteriores, el litio y el hidrógeno, se coloca debajo de ellos en la tabla periódica. Es obvio que al pasar del sodio al argón, todas las configuraciones electrónicas externas anteriores encontradas en el segundo periodo (n = 2) serán duplicadas por los elementos del tercer periodo llenando los orbitales de 3 s y 3 p. Por ejemplo, la estructura electrónica del fósforo (Z = 15) será
y así parecerse al nitrógeno.
Argón. Z = 18. El argón habrá llenado orbitales de 3 s y 3 p y representará el final de un periodo. El argón, al igual que el helio y el neón, posee una estructura de concha cerrada y se coloca debajo de estos dos elementos en la tabla periódica.
Los elementos de transición
El inicio del cuarto periodo estará marcado por la ocupación simple y doble de la órbita de 4 s para dar potasio y calcio respectivamente. Sin embargo, la referencia al diagrama de nivel de energía orbital indica que el orbital de 3 d es más estable que el orbital de 4 p. Dado que hay cinco orbitales d pueden contener un total de diez electrones. Así, los diez elementos que comienzan con escandio (Z = 21) poseerán estructuras electrónicas que difieren de cualquiera que los preceda, ya que son los primeros elementos que llenan los orbitales d. Una configuración electrónica típica de uno de estos elementos es la del manganeso: [Ar] 4 s 2 3 d 5. El símbolo [Ar] es una forma abreviada de indicar que las capas internas de electrones sobre manganeso poseen la misma configuración orbital que las del argón. Además, el símbolo 3 d 5 indica que hay cinco electrones en los orbitales de 3 d, no se hace distinción alguna entre los cinco orbitales d diferentes. Esta serie de elementos en los que se llenan los orbitales de 3 d se denomina la primera serie de transición. El elemento zinc con una configuración [Ar] 4 s 2 3 d 10 marca el final de esta serie. Los seis elementos del galio al criptón marcan el llenado de los orbitales de 4 p y el cierre, con criptón, de la cuarta concha cuántica y el cuarto periodo de la tabla.
Mientras que los orbitales de 3 d son menos estables que los orbitales de 4 s en el átomo neutro (con las excepciones de Cr y Cu) y se llenan solo después de que se rellenan los orbitales de 4 s, la estabilidad relativa de los orbitales de 4 s y 3 d se invierte en el iónico formas de los metales de transición. Por ejemplo, la configuración del ion que resulta cuando el átomo de manganeso pierde dos electrones es Mn +2 [Ar] 3 d 5 y no [Ar] 4 s 2 3 d 3. Este es un resultado general. Los d orbitales del número cuántico n se llenan solo después de que el orbital s del número cuántico (n + 1) se rellena en el átomo neutro, pero el nd orbital es más estable que el orbital (n + l) s en el correspondiente ion.
El quinto periodo comienza con el llenado de la órbita de 5 s, seguido del llenado de los orbitales de 4 d, lo que genera la segunda serie de elementos de transición. El periodo cierra con el llenado de los orbitales de 5 p y termina con xenón.
Los elementos lantánidos y actínidos
El sexto periodo se inicia con el llenado de la órbita de 6 s. El siguiente elemento, lantano, tiene la configuración electrónica [Xe] 6 s 2 5 d 1. Sin embargo, los siguientes catorce elementos representan el inicio de otra nueva serie, ya que el llenado de los orbitales de 4 f se ve ahora favorecido energéticamente sobre un aumento continuo de la población de los orbitales de 5 d. Obsérvese que el efecto de penetración muy pequeño que poseen los orbitales 4 f (n = 4) retrasa su aparición hasta que la sexta capa cuántica se haya llenado parcialmente. Hay catorce elementos en esta serie, llamados serie lantánidos, ya que hay siete orbitales 4 f (l = 3 y 2 '3+1 = 7).
La tercera serie de transición sigue los elementos lantánidos a medida que se completa la ocupación de los orbitales de 5 d. Esto a su vez es seguido por el llenado de los orbitales de 6 p. El periodo final comienza con el llenado de la órbita de 7 s y continúa con el llenado de los orbitales de 5 f. Esta segunda serie de elementos con electrones en orbitales f se llama serie de actínidos.
El concepto de orbitales atómicos en conjunto con el principio Pauli ha predicho efectivamente una periodicidad en las estructuras electrónicas de los elementos. La forma de esta periodicidad duplica exactamente la que se encuentra en la tabla periódica de los elementos en los que la periodicidad se basa en las propiedades químicas y físicas observadas de los elementos. Nuestra siguiente tarea será determinar si nuestras estructuras electrónicas propuestas predecirán y explicarán adecuadamente las variaciones observadas en las propiedades químicas y físicas de los elementos.

