6.2: Una interpretación electrostática del enlace químico
- Page ID
- 69413
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Una interpretación electrostática del enlace químico
A la luz de la discusión anterior sobre una distribución de densidad molecular de electrones, podemos considerar una molécula como dos o más núcleos incrustados en una distribución tridimensional rígida de carga negativa. Existe un teorema de la mecánica cuántica que nos permite hacer uso directo de esta imagen de una molécula. Este teorema establece que la fuerza que actúa sobre un núcleo en una molécula puede ser determinada por los métodos de la electrostática clásica. Los núcleos de una molécula se repelen unos a otros, ya que son de igual carga. Esta fuerza de repulsión, si se desequilibra, separaría los núcleos y la molécula se separaría en átomos. En una molécula estable, sin embargo, la fuerza nuclear de repulsión se equilibra con una fuerza atractiva ejercida por la distribución de densidad electrónica cargada negativamente. La utilidad de este enfoque radica en que podemos explicar y discutir la estabilidad de las moléculas en términos del concepto clásico de equilibrio entre las fuerzas electrostáticas de atracción y repulsión. Podemos ilustrar este método y llegar a algunos resultados de carácter general considerando en detalle las fuerzas que actúan sobre los núcleos de la molécula de hidrógeno.
La carga en un núcleo de hidrógeno es + e y la fuerza de repulsión que actúa sobre cualquiera de los núcleos es
|
|
donde R es la distancia internuclear. Esta fuerza obviamente actúa para separar los dos núcleos (Fig. 6-3).
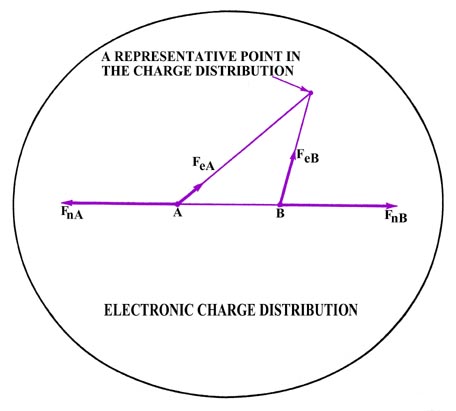
Fig. 6-3. Las fuerzas que actúan sobre los núcleos en H 2. Solo se muestra un contorno externo de la distribución de densidad electrónica. Más del 99% de la carga electrónica total está contenida dentro de este contorno.
La fuerza atractiva que equilibra esta fuerza de repulsión y une los núcleos es ejercida por la distribución de densidad electrónica cargada negativamente. La distribución de densidad se trata como una distribución rígida de carga negativa en el espacio. Cada elemento pequeño de esta distribución de carga ejerce una fuerza sobre los núcleos, ilustrada en la figura 6-3 para un punto de carga tan pequeño. Las fuerzas que ejerce sobre los núcleos están etiquetadas F e A y F e B. La cantidad total de carga negativa en la distribución de densidad electrónica debe corresponder a algún número integral de electrones. Sin embargo, la cantidad de carga negativa en cada pequeña región del espacio corresponderá en general a alguna fracción de una carga electrónica.
La fuerza electrónica de atracción F e A o F e B puede equipararse a dos componentes, uno a lo largo del enlace y otro perpendicular a él. La distribución de densidad es simétrica con respecto al eje internuclear, es decir, por cada punto de carga por encima del eje debe haber, por simetría, otro punto de igual carga en el lugar correspondiente debajo del eje internuclear. El punto de carga simétricamente relacionado ejercerá la misma fuerza a lo largo de la unión, pero el componente perpendicular al enlace estará en la dirección opuesta. Así, las fuerzas perpendiculares de atracción ejercidas sobre los núcleos son cero (Fig. 6-4) y podemos limitar nuestra atención a los componentes de la fuerza de atracción a lo largo del enlace.
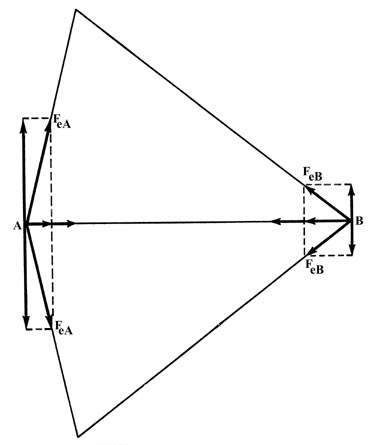
Fig. 6-4. Los dos componentes de fuerza a lo largo de la unión se suman mientras que los dos componentes perpendiculares se cancelan tanto en A como en B.
Es obvio que todos los elementos de carga que se encuentran en la región general entre los dos núcleos ejercerán fuerzas que junten los dos núcleos. La fuerza ejercida por la densidad en esta región actúa en oposición a la fuerza de la repulsión nuclear y une los dos núcleos entre sí. También es claro que un elemento de carga en la región detrás de cualquiera de los núcleos ejercerá una fuerza que tiende a aumentar la distancia entre los núcleos (Fig. 6-5).
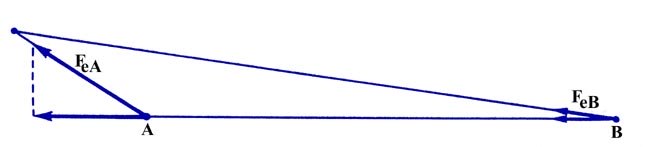
Fig. 6-5. El componente de F e A lo largo del enlace es mayor que el componente correspondiente de F e B.
Dado que el elemento de carga está más cerca del núcleo A que al núcleo B, el componente de la fuerza sobre A a lo largo de la unión será mayor que el componente de la fuerza sobre B a lo largo del enlace. Así, el efecto de la densidad en esta región será separar la molécula en átomos.
También debe haber una línea sobre la que la densidad ejerza la misma fuerza sobre ambos núcleos y así no aumente ni disminuya R porque la densidad de carga en una región dibuja los núcleos juntos y en otra los separe. El elemento de carga mostrado en la Fig. 6-6 ejerce la misma fuerza a lo largo de la unión tanto en A como en B aunque está más cerca de B que a A. Aunque la fuerza total F e B es mucho mayor que F e A, F e B se dirige casi perpendicular al eje de unión y por lo tanto su componente a lo largo del enlace es bastante pequeño e igual al componente de F e A lo largo del enlace. La densidad de carga en cualquiera de las dos curvas mostradas en la Fig. 6-6 ejerce fuerzas iguales en ambos núcleos a lo largo del enlace, y dicha densidad de carga no tenderá a aumentar o disminuir la distancia entre los núcleos. Así, estas dos curvas (superficies en tres dimensiones) dividen el espacio en una molécula en una región de unión y una región antiunión. Cualquier densidad de carga entre las dos curvas límite, en la región de unión, dibuja los dos núcleos juntos, mientras que cualquier densidad de carga en la región rayada detrás de cualquiera de las curvas, la región antiunión, ejerce fuerzas desiguales sobre los núcleos y separa el molécula en átomos.
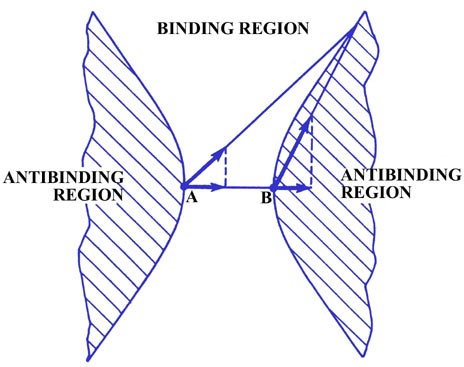
Fig. 6-6. Las curvas límite que separan la unión de las regiones antiunión en una molécula diatómica homonuclear.
Un enlace químico es así el resultado de la acumulación de densidad de carga negativa en la región entre los núcleos en una medida suficiente para equilibrar las fuerzas nucleares de repulsión. Esto corresponde a un estado de equilibrio electrostático ya que la fuerza neta que actúa sobre cada núcleo es cero para este valor particular de la distancia internuclear. Si la distancia entre los núcleos se incrementa desde el valor de equilibrio, se disminuye la fuerza nuclear de repulsión. Al mismo tiempo, la fuerza de atracción ejercida por la distribución de la densidad de electrones se incrementa a medida que aumenta el tamaño de la región de unión. Así, cuando R se incrementa a partir de su valor de equilibrio, hay fuerzas netas de atracción que actúan sobre los núcleos que vuelven a juntar los dos núcleos. Se tendría que aplicar una fuerza definida para superar la fuerza de atracción ejercida por la distribución de densidad electrónica y separar la molécula en átomos. De igual manera, si el valor de R disminuye de su valor de equilibrio, la fuerza de repulsión nuclear se incrementa sobre su valor de equilibrio. Al mismo tiempo, la fuerza de atracción ejercida por la densidad de electrones disminuye, debido a que la región de unión disminuye de tamaño. En este caso habrá una fuerza neta de repulsión empujando los dos núcleos separándolos y volviendo a su separación de equilibrio. Existe así un valor de R para el cual las fuerzas sobre los núcleos son cero y toda la molécula se encuentra en un estado de equilibrio electrostático.
La división del espacio alrededor de una molécula en una región de unión y una región antiunión muestra dónde se debe concentrar la densidad de carga para obtener un enlace químico estable. La siguiente pregunta que hay que responder es: “¿Cuánta carga se debe colocar en la región de unión para lograr el equilibrio electrostático?” Por ejemplo, podríamos considerar la posibilidad de formar una molécula reuniendo dos átomos, cada uno con su propia distribución atómica de carga, y simplemente permitir que las dos distribuciones de carga atómica se superpongan sin deformarse de ninguna manera. Esto daría como resultado la acumulación de aproximadamente el doble de densidad de carga en la región de unión que en cualquiera de las regiones antiunión detrás de los núcleos. ¿Esta duplicación de la densidad de carga en la región entre los núcleos sería suficiente para equilibrar las fuerzas nucleares de repulsión? Respondamos a esta pregunta para el simple caso de dos átomos de hidrógeno que forman hidrógeno molecular, pero nuevamente el resultado será general.
El estado más estable de la molécula de hidrógeno se obtiene cuando dos átomos de hidrógeno, cada uno en su estado atómico más estable, se acercan entre sí. El estado fundamental de un átomo de hidrógeno se obtiene cuando el electrón se encuentra en el orbital de 1 s. La distribución de la densidad alrededor de cada núcleo hidrogren es la esférica que discutimos previamente con cierto detalle. Primero calcularemos la fuerza sobre uno de los núcleos de hidrógeno resultante cuando los dos átomos están muy separados. La situación se representa en la Fig. 6-7 donde cada distribución de carga atómica está representada por un único contorno circular exterior. Este contorno es para definir una esfera que en tres dimensiones contiene esencialmente toda la carga electrónica de cada átomo.
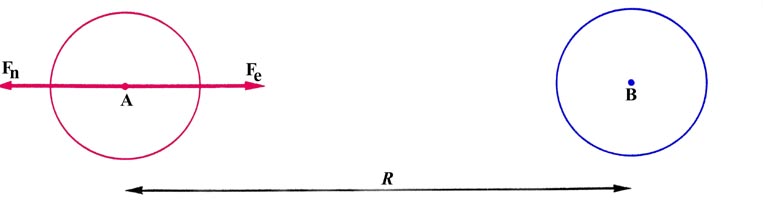
Fig. 6-7. Las fuerzas que actúan sobre el núcleo A a grandes distancias internucleares, R.
Consideremos las fuerzas ejercidas sobre el núcleo A. La fuerza de la repulsión nuclear es justa
|
|
La densidad de carga atómica centrada en el núcleo A no ejerce ninguna fuerza neta sobre este núcleo, ya que tira por igual en todas direcciones debido a su simetría esférica. Existe, sin embargo, una fuerza neta de atracción debido a la carga electrónica única dispersa en la distribución atómica de B. Un teorema de la electrostática clásica establece que la fuerza ejercida por una distribución de carga esférica sobre una carga puntual que se encuentra fuera de la distribución de carga es igual a la fuerza que se obtendría si toda la carga en la distribución se concentrara en su centro. El núcleo A es una carga puntual que se encuentra fuera de la distribución de carga esférica centrada en B. Así, la fuerza ejercida sobre el núcleo A por esta distribución de carga es justa
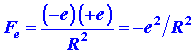 |
ya que la cantidad total de carga contenida en la distribución es la de un electrón. La fuerza total que actúa sobre el núcleo A es
|
|
Una fuerza cero es la respuesta esperada cuando los dos átomos están muy separados.
¿Podemos equilibrar nuevamente las fuerzas para un valor de R que es del orden de magnitud de un diámetro atómico, es decir, típico de los valores de R que se encuentran en las moléculas? A este valor de R, cada núcleo habrá penetrado en la densidad de carga que rodea al otro núcleo. Recordemos que en este cálculo insistimos en que las densidades de carga atómica permanezcan esféricas y nuestra densidad de carga molecular se obtenga al permitir que las dos distribuciones rígidas de carga atómica se superpongan entre sí (Fig. 6-8).
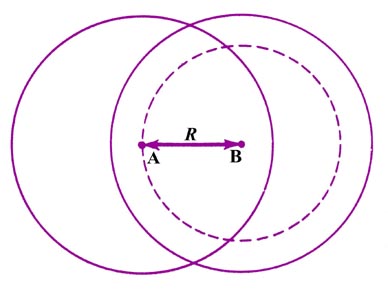 |
Fig. 6-8. Las fuerzas externas en el núcleo A para el solapamiento de distribuciones rígidas de carga atómica. Solo la densidad de carga sobre B que está contenida en la esfera del radio R ejerció una fuerza sobre el núcleo A. |
La fuerza de repulsión nuclear en este caso sigue dada por
|
|
donde el valor de R es mucho menor que en el cálculo anterior. Dado que la distribución de carga en A sigue siendo de forma esférica, no ejerce ninguna fuerza neta sobre el núcleo A. La fuerza ejercida sobre el núcleo A por la densidad de carga sobre B puede ser calculada nuevamente por el teorema al que se ha hecho referencia anteriormente. Sin embargo, el núcleo A ya no se encuentra fuera de toda la densidad de carga en B. El valor de R es significativamente menor que el radio de la distribución de carga en B. Toda la densidad de carga en B que se encuentra dentro de la esfera definida por la longitud de enlace R nuevamente ejerce una fuerza sobre el núcleo A, igual a la obtenida si toda esta densidad estuviera situada en el núcleo B. El teorema mencionado anteriormente muestra que la densidad sobre B que se encuentra fuera de esta esfera definida por R no ejerce fuerza neta sobre el núcleo A.
Dado que R es menor que el diámetro de la distribución de carga, la cantidad de carga negativa contenida en una esfera de radio R será menor que la de un electrón. El valor observado de R para la molécula de hidrógeno es 1.4 au y la referencia a los datos dados previamente para la densidad orbital de 1 s para el átomo de hidrógeno muestra que una esfera de radio 1.4 contendría aproximadamente la mitad de una carga electrónica. La fuerza electrostática de atracción ejercida sobre el núcleo A es, por lo tanto,
|
|
La fuerza neta sobre el núcleo A es
|
|
Existe una fuerza neta de repulsión ejercida sobre el núcleo A bajo estas condiciones. Si R se redujera aún más, el núcleo A penetraría la densidad de carga alrededor de B en una medida aún mayor y “vería” aún más de la carga nuclear en B. La fuerza sobre los núcleos será así repulsiva para todos los valores finitos de R.
Este es un resultado importante ya que muestra que la distribución de densidad en una molécula no puede considerarse como la simple suma de las dos densidades de carga atómica. La superposición de densidades atómicas rígidas no coloca suficiente densidad de carga en la región de unión para superar la fuerza nuclear de repulsión. Concluimos que las distribuciones originales de carga atómica deben distorsionarse en la formación de una molécula, y la distorsión es tal que la densidad de carga se concentra en la región de unión entre los núcleos. Un cálculo mecánico cuántico predice este mismo resultado. El cálculo muestra que existe una distorsión continua de las distribuciones de densidad atómica originales, distorsión que aumenta a medida que disminuye la distancia internuclear. Esto se ilustra en la Fig. 6-9 para el acercamiento de dos átomos de hidrógeno para formar la molécula de hidrógeno.
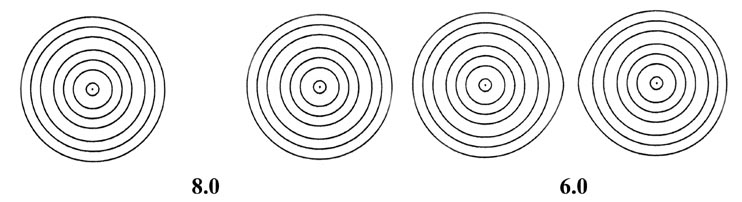
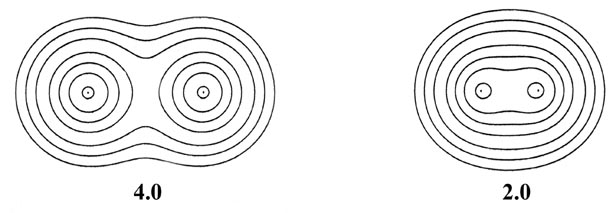
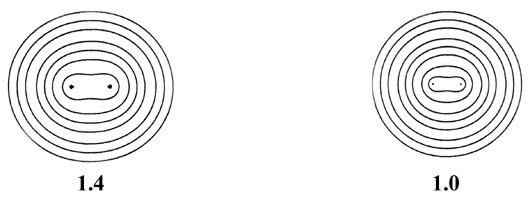
Fig. 6-9. Una serie de mapas de contorno de densidad electrónica que ilustran los cambios en la distribución de la carga de electrones durante el acercamiento de dos átomos de H para formar H 2. La distancia internuclear R en unidades de au se indica debajo de cada mapa. A R = 8 las densidades atómicas parecen no distorsionadas. A R = 6 las densidades están distorsionadas pero aún esencialmente separadas. A medida que R disminuye aún más, los contornos de densidad de carga de valor creciente cubren ambos núcleos, y la densidad de carga se acumula en las posiciones de los núcleos y en la región internuclear. Los valores de los contornos en au aumentan de la más externa a la más interna en el orden 2 '10 - n, 4' 10 - n, 8 '10 - n, para valores decrecientes de n comenzando con n = 3. Así, el contorno más externo en cada caso es 0.002 au y el valor del contorno más interno para R = 1.0 au, por ejemplo, es 0.4.
Los cambios en las distribuciones originales de densidad atómica causados por la formación del enlace químico pueden aislarse y estudiarse directamente mediante la construcción de una distribución de diferencia de densidad. Dicha distribución se obtiene restando la densidad obtenida del solapamiento de las densidades atómicas no distorsionadas separadas por una distancia R, de la distribución de carga molecular evaluada al mismo valor de R. Dondequiera que esta diferencia de densidad sea positiva en valor significa que la densidad electrónica en la molécula es mayor que la obtenida del simple solapamiento de las densidades atómicas originales. Donde la diferencia de densidad es negativa, significa que hay menos densidad en este punto en el espacio en la molécula que en la distribución obtenida del solapamiento de las distribuciones atómicas originales. Tal mapa de diferencia de densidad proporciona así una imagen detallada de la reorganización neta de la densidad de carga de los átomos separados que acompañan a la formación de una molécula.
Acabamos de demostrar que la distribución de densidad resultante del solapamiento de las densidades atómicas no distorsionadas no coloca suficiente densidad de carga en la región de unión para equilibrar las fuerzas de repulsión nuclear. Las regiones de incremento de carga en los mapas de diferencia de densidad son, por lo tanto, las regiones a las que se transfiere la carga con relación a los átomos separados para obtener un estado de equilibrio electrostático y de ahí un enlace químico. Desde este punto de vista, un mapa de diferencias de densidad nos proporciona una imagen de la “densidad de enlaces”.
La Figura 6-10 muestra un conjunto de mapas de diferencia de densidad o densidad de enlaces para la aproximación de dos átomos de hidrógeno para formar la molécula de hidrógeno. En separaciones muy grandes, por ejemplo a 8 au, la distribución de densidad en cada átomo se polariza en la dirección del átomo que se aproxima. La densidad de carga se ha transferido de la región antiunión detrás de cada núcleo a la región de unión inmediatamente frente a cada núcleo. Así, incluso en grandes separaciones, las distribuciones de densidad atómica ya no son esféricas. Señalamos en nuestra discusión sobre el enfoque de dos átomos de hidrógeno rígidos que una distribución de carga esférica no ejerce una fuerza neta sobre el núcleo en el que se centra. Sin embargo, cada distribución de carga atómica polarizada ejerce una fuerza atractiva sobre su núcleo. Las densidades polarizadas colocan más carga en el lado de unión de cada núcleo que en el lado antiunión. Estas fuerzas atractivas de largo alcance, llamadas fuerzas de dispersión o de van der Waals, podrían describirse acertadamente como un “efecto bootstrap” ya que cada núcleo es arrastrado por su propia densidad de carga. Todos los pares de moléculas neutras sufren este tipo de polarización como resultado de las interacciones de largo alcance entre ellas, y existen fuerzas atractivas operativas entre todos los pares de moléculas hacia distancias muy grandes. Si bien las polarizaciones de largo alcance y las fuerzas de atracción resultantes son muy débiles, son de extrema importancia. Se les conoce comúnmente como fuerzas de van der Waals y son los únicos responsables de la unión observada en ciertos tipos de sólidos, helio sólido por ejemplo. Esto se discutirá más a fondo más adelante.
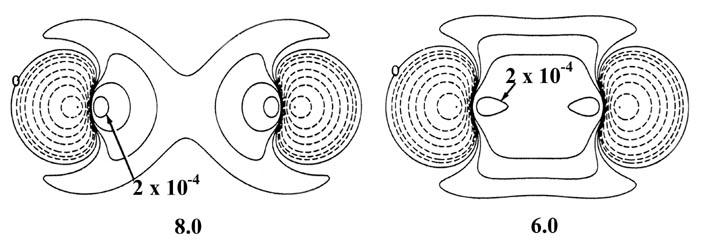
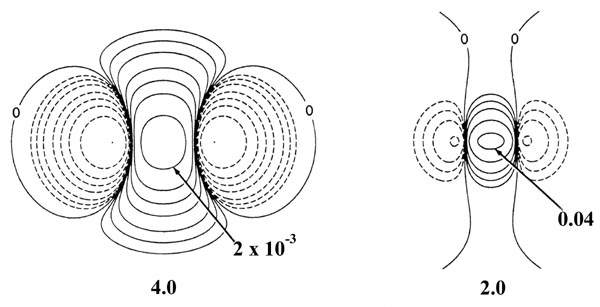
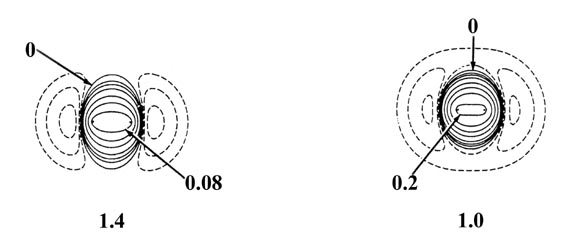
Fig. 6-10. Distribución de diferencias de densidad (molecular menos atómica) para el acercamiento de dos átomos de H. Estos mapas indican los cambios en las densidades atómicas causados por la formación de una molécula. Los contornos sólidos representan un aumento en la densidad de carga sobre el caso atómico, mientras que los contornos discontinuos denotan una disminución en la densidad de carga en relación con las densidades atómicas. Dado que los cambios en la densidad de carga son mucho menores para valores grandes de R que para valores pequeños de R se utilizan dos escalas diferentes. Los contornos sólidos y discontinuos aumentan (+) o disminuyen (-) respectivamente desde el contorno cero en el orden ±2 '10 - n, ±4' 10 - n, ±8 '10 - n au para valores decrecientes de n. Los mapas para R = 8.0, 6.0 y 4.0 au comienzan con n = 5 y los de R = 2.0, 1.4 y 1.0 au comienzan con n = 3. El contorno cero y el valor del contorno positivo más interno se indican en cada caso. Obsérvese el incremento continuo en la densidad de carga en la región entre los núcleos a medida que R disminuye.
A 6.0 au el aumento de densidad en la región de unión es común a ambos núcleos, y para distancias menores a 6.0 au el sistema ya no puede describirse como dos átomos de hidrógeno polarizados. Las distorsiones de las densidades originales causadas por la transferencia de carga a la región de unión son tan grandes que el carácter individual de las densidades atómicas ya no es discernible. La magnitud de la fuerza de atracción (que es de signo negativo) ejercida sobre los núcleos por esta acumulación de densidad de carga en la región de unión aumenta rápidamente para distancias menores a 4.5 au (Fig. 6-11).
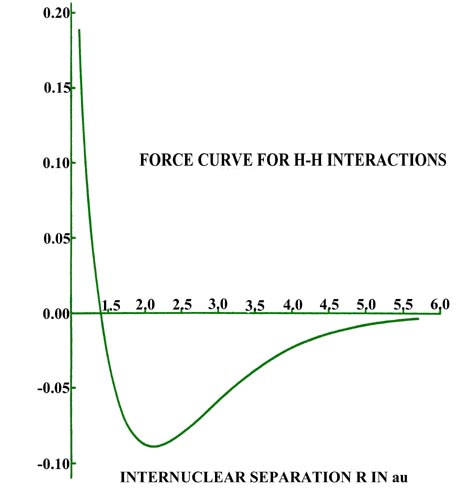 |
Fig. 6-11. La fuerza sobre un núcleo H en H 2 en función de la separación internuclear. Una fuerza atractiva es de signo negativo; una replusiva, positiva. |
La fuerza de atracción alcanza un máximo en 2.1 au. Los diagramas de diferencia de densidad indican que para distancias tan pequeñas como 2.0 au, el aumento de densidad se limita a la región entre los núcleos. Para separaciones menores de 2.0 au, se transfiere una cantidad creciente de densidad de carga a las regiones antiunión detrás de cada núcleo. Debido a esto, la fuerza de atracción sobre los núcleos disminuye rápidamente con una disminución adicional de R hasta que a R = 1.4 au, la fuerza neta de atracción ejercida por la densidad de carga apenas equilibra la fuerza de repulsión nuclear (Fig. 6-11). Se alcanza un estado de equilibrio electrostático y se forma un enlace químico. Una disminución adicional en R conduce a una fuerza de repulsión. Más densidad de carga se transfiere a las regiones antiunión, y la fuerza ejercida por esta densidad de carga, actuando en concierto con el aumento de la fuerza de repulsión nuclear, supera a la fuerza de atracción ejercida por la densidad de carga en la región de unión.
Los mismos cambios de densidad se representan en la Fig. 6-12, que es una serie de perfiles a lo largo del eje internuclear de los mapas de diferencia de densidad mostrados en la Fig. 6-10. Los mapas de perfil ilustran de manera llamativa la acumulación de densidad de carga en la región entre los núcleos.
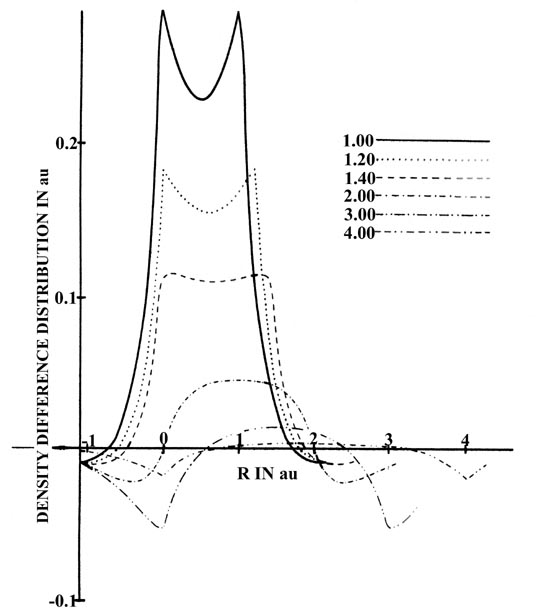 |
Fig. 6-12. Perfiles de la diferencia de densidad a lo largo del eje internuclear para H 2 en una serie de separaciones internucleares. Un núcleo se mantiene fijo, y el otro se mueve con relación a él. Las separaciones se indican en el diagrama. |
La formación de cualquier enlace químico es cualitativamente similar a los cambios en la distribución de carga y en las fuerzas ejercidas sobre los núcleos que se encuentran para la molécula de hidrógeno. Ahora debemos investigar las condiciones que determinan si se puede acumular o no suficiente densidad de carga en la región de unión para producir una molécula estable. Dado que no todos los átomos forman enlaces químicos, claramente deben existir tales condiciones.

