2.5: Ley de Derrame de Graham
- Page ID
- 72378
Una consecuencia importante de la teoría molecular cinética es lo que predice en términos de efectos de efusión y difusión. El derrame se define como una pérdida de material a través de un límite. Un ejemplo común de derrame es la pérdida de gas dentro de un globo a lo largo del tiempo.
La velocidad a la que los gases se derramarán de un globo se ve afectada por una serie de factores. Pero una de las más importantes es la frecuencia con la que las moléculas chocan con la superficie interior del globo. Dado que esta es una función de la velocidad molecular promedio, tiene una dependencia inversa de la raíz cuadrada del peso molecular.
\[\text{Rate of effusion} \propto \dfrac{1}{\sqrt{MW}}\]
Esto puede ser utilizado para comparar las tasas relativas de efusión para gases de diferentes masas molares.
El experimento celular de Knudsen
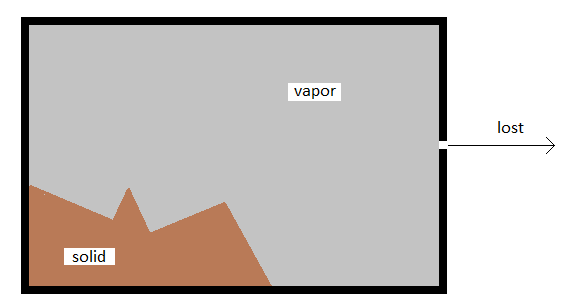
Una celda Knudsen es una cámara en la que se mantiene una muestra termalizada de gas, pero se deja que se derrame a través de un pequeño orificio en la pared. La muestra de gas se puede modelar utilizando el modelo de Teoría Molecular Cinética como una colección de partículas que viajan por toda la celda, colisionando entre sí y también con la pared. Si hay un pequeño orificio, cualquier molécula que colisionaría con esa porción de la pared se perderá a través del orificio.
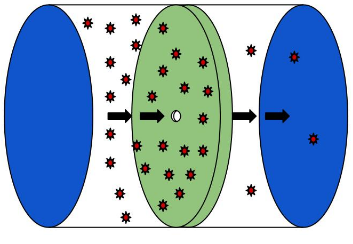 \
\Esto hace una disposición conveniente para medir la presión de vapor del material dentro de la celda, ya que la masa total perdida por efusión a través del orificio será proporcional a la presión de vapor de la sustancia. La presión de vapor puede estar relacionada con la masa perdida por la expresión
\[ p = \dfrac{g}{A \Delta t} \sqrt{\dfrac{2 \pi RT}{MW}}\]
donde\(g\) esta la masa perdida,\(A\) es el área del orificio,\(\Delta t\) es el tiempo que se permite que proceda el derrame,\(T\) es la temperatura y\(MW\) es la masa molar del compuesto en la fase vapor. La presión es dada entonces por\(p\). A continuación se muestra un esquema de cómo podría ser una celda Knudsen.