1.3: Efecto fotoeléctrico explicado con hipótesis cuántica
- Page ID
- 79530
- Familiarizarse con el efecto fotoelectrón para materiales a granel
- Comprender cómo la energía cinética del fotoelectrón y la intensidad varían en función de la longitud de onda de la
- Comprender cómo la energía cinética del fotoelectrón y la intensidad varían en función de la intensidad de la luz incidente
- Describir qué es una función de trabajo y relacionarla con la energía de ionización
- Describir el efecto fotoeléctrico con el modelo de luz de fotones cuantificados de Einstein
La naturaleza, al parecer, estaba cuantificada (no continua o discreta). Si esto fuera así, ¿cómo podrían las ecuaciones de Maxwell predecir correctamente el resultado del radiador de cuerpo negro? Planck pasó mucho tiempo tratando de conciliar el comportamiento de las ondas electromagnéticas con la naturaleza discreta de la radiación de cuerpo negro, sin éxito. No fue hasta 1905, con otro artículo publicado por Albert Einstein, que la naturaleza ondulada de la luz se expandió para incluir la interpretación de partículas de la luz que explicaba adecuadamente la ecuación de Planck.
El efecto fotoeléctrico fue documentado por primera vez en 1887 por el físico alemán Heinrich Hertz y, por lo tanto, a veces se le conoce como el efecto Hertz. Mientras trabajaba con un transmisor de chispa (un dispositivo primitivo de radiodifusión), Hertz descubrió que al absorber ciertas frecuencias de luz, las sustancias desprenderían una chispa visible. En 1899, esta chispa fue identificada como electrones excitados por luz (llamados fotoelectrones) que abandonaban la superficie del metal por J.J. Thomson (Figura 1.3.1 ).
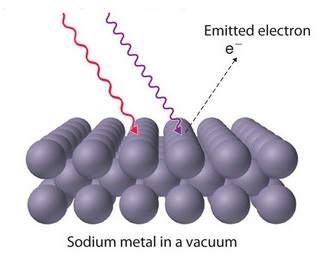
La imagen clásica subyacente al efecto fotoelectrónico fue que los átomos en el metal contenían electrones, que fueron sacudidos y hechos vibrar por el campo eléctrico oscilante de la radiación incidente. Eventualmente algunos de ellos serían sacudidos sueltos, y serían expulsados del cátodo. Vale la pena considerar cuidadosamente cómo se esperaría que el número y la velocidad de los electrones emitidos varíen con la intensidad y el color de la radiación incidente junto con el tiempo necesario para observar los fotoelectrones.
- Aumentar la intensidad de la radiación sacudiría más violentamente los electrones, por lo que uno esperaría que se emitieran más, y dispararían a mayor velocidad, en promedio.
- Aumentar la frecuencia de la radiación sacudiría los electrones más rápido, por lo que podría hacer que los electrones salgan más rápido. Para una luz muy tenue, tardaría algo de tiempo para que un electrón trabajara hasta una amplitud de vibración suficiente para sacudirse suelto.
Resultados Experimentales de Lenard (Dependencia de Intensidad)
En 1902, el estudiante de Hertz, Philipp Lenard, estudió cómo la energía de los fotoelectrones emitidos variaba con la intensidad de la luz. Utilizó una luz de arco de carbono y podría aumentar la intensidad mil veces. Los electrones expulsados chocaron con otra placa metálica, el colector, que estaba conectado al cátodo por un cable con un amperímetro sensible, para medir la corriente producida por la iluminación (Figura 1.3.2 ). Para medir la energía de los electrones expulsados, Lenard cargó negativamente la placa colectora, para repeler a los electrones que llegaban hacia ella. Así, sólo los electrones expulsados con suficiente energía cinética para subir esta colina potencial contribuirían a la corriente.
Lenard descubrió que había un voltaje mínimo bien definido que impidió que los electrones pasaran por (\(V_{stop}\)). Para sorpresa de Lenard, encontró que ¡\(V_{stop}\)no dependía en absoluto de la intensidad de la luz! Al duplicar la intensidad de la luz se duplicó el número de electrones emitidos, pero no afectó las energías cinéticas de los electrones emitidos. El campo oscilante más potente expulsó más electrones, pero la energía individual máxima de los electrones expulsados fue la misma que para el campo más débil (Figura 1.3.2 ).
Resultados experimentales de Millikan (dependencia de la longitud de onda)
El físico experimental estadounidense Robert Millikan dio seguimiento a los experimentos de Lenard y utilizando una poderosa lámpara de arco, pudo generar suficiente intensidad de luz para separar los colores y verificar el efecto fotoeléctrico usando luz de diferentes colores. Encontró que la energía máxima de los electrones expulsados sí dependía del color: la longitud de onda más corta, la luz de mayor frecuencia expulsa fotoelectrones con mayor energía cinética (Figuras 1.3.3 ).
Como se muestra en la Figura 1.3.4 , solo el comportamiento opuesto al clásico se observa en los experimentos de Lenard y Millikan. La intensidad afecta el número de electrones, y la frecuencia afecta la energía cinética de los electrones emitidos. A partir de estos bocetos, vemos que
- la energía cinética de los electrones es linealmente proporcional a la frecuencia de la radiación incidente por encima de un valor umbral de\(ν_0\) (no se observa corriente a continuación\(ν_0\)), y la energía cinética es independiente de la intensidad de la radiación, y
- el número de electrones (es decir, la corriente eléctrica) es proporcional a la intensidad e independiente de la frecuencia de la radiación incidente por encima del valor umbral de\(ν_0\) (es decir, no se observa corriente a continuación\(ν_0\)).
La teoría clásica predice que la energía transportada por la luz es proporcional a su amplitud independientemente de su frecuencia, y esto no explica correctamente la dependencia observada de la longitud de onda en las observaciones de Lenard y Millikan.
Al igual que con la mayoría de los resultados experimentales que discutimos en este texto, el comportamiento descrito anteriormente es una simplificación de los verdaderos resultados experimentales observados en el laboratorio. Una descripción más compleja implica una mayor introducción de física e instrumentación más complejas, que serán ignoradas por ahora.
La imagen cuántica de Einstein
En 1905 Einstein dio una interpretación muy simple de los resultados de Lenard y tomó prestada la hipótesis de Planck sobre la energía cuantificada de su investigación de cuerpos negros y asumió que la radiación entrante debía considerarse como cuantos de energía\(h\nu\), con\(\nu\) la frecuencia. En la fotoemisión, uno de esos cuánticos es absorbido por un electrón. Si el electrón está a cierta distancia en el material del cátodo, se perderá algo de energía a medida que se mueva hacia la superficie. Siempre habrá algún costo electrostático ya que el electrón sale de la superficie, que es la función de trabajo,\(\Phi\). Los electrones más energéticos emitidos serán aquellos muy cercanos a la superficie, y dejarán el cátodo con energía cinética
\[KE = h\nu - \Phi \label{Eq1} \]
Al arrancar el voltaje negativo en la placa colectora hasta que la corriente apenas se detiene, es decir, a\(V_{stop}\), los electrones de mayor energía cinética (\(KE_e\)) deben haber tenido energía\(eV_{stop}\) al salir del cátodo. Por lo tanto,
\[eV_{stop} = h\nu - \Phi \label{Eq2} \]
Así, la teoría de Einstein hace una predicción cuantitativa muy definida: si se varía la frecuencia de la luz incidente, y se\(V_{stop}\) traza en función de la frecuencia, la pendiente de la línea debe ser\(\frac{h}{e}\) (Figura\(\PageIndex{4A}\)). También está claro que existe una frecuencia de luz mínima para un metal dado\(\nu_o\), aquella para la cual el cuántico de energía es igual a\(\Phi\) (Ecuación\ ref {Eq1}). La luz por debajo de esa frecuencia, no importa cuán brillante sea, no expulsará electrones.
Según Planck y Einstein, la energía de la luz es proporcional a su frecuencia más que a su amplitud, habrá una frecuencia mínima\(\nu_0\) necesaria para expulsar un electrón sin energía residual.
Dado que cada fotón de energía suficiente excita solo un electrón, aumentar la intensidad de la luz (es decir, el número de fotones/seg) solo aumenta el número de electrones liberados y no su energía cinética. Además, no es necesario tiempo para que el átomo se caliente a una temperatura crítica y por lo tanto la liberación del electrón es casi instantánea tras la absorción de la luz. Finalmente, debido a que los fotones deben estar por encima de cierta energía para satisfacer la función de trabajo, existe una frecuencia umbral por debajo de la cual no se observan fotoelectrones. Esta frecuencia se mide en unidades de Hertz (1/segundo) en honor al descubridor del efecto fotoeléctrico.
La ecuación de Einstein\(\ref{Eq1}\) explica cuantitativamente las propiedades del efecto fotoeléctrico. Una extraña implicación de este experimento es que la luz puede comportarse como una especie de “partícula” sin masa ahora conocida como fotón cuya energía\(E=h\nu\) puede ser transferida a una partícula real (un electrón), impartiendo energía cinética a la misma, al igual que en una colisión elástica entre partículas masivas tales como bolas de billar.
Robert Millikan inicialmente no aceptó la teoría de Einstein, que vio como un ataque a la teoría de las olas de la luz, y trabajó durante diez años hasta 1916, en el efecto fotoeléctrico. Incluso ideó técnicas para raspar limpiar las superficies metálicas dentro del tubo de vacío. A pesar de todos sus esfuerzos encontró resultados decepcionantes: confirmó la teoría de Einstein después de diez años. En lo que escribe en su artículo, Millikan sigue luchando desesperadamente para evitar esta conclusión. Sin embargo, para el momento de su discurso de aceptación del Premio Nobel, ¡ha cambiado de opinión bastante drásticamente!
La simple explicación de Einstein (Ecuación\ ref {Eq1}) explicó completamente los fenómenos observados en los experimentos de Lenard y Millikan (Figura 1.3.4 ) e inició una investigación sobre el campo que ahora llamamos mecánica cuántica. Este nuevo campo busca proporcionar una explicación cuántica para la mecánica clásica y crear una teoría más unificada de la física y la termodinámica. El estudio del efecto fotoeléctrico también ha llevado a la creación de un nuevo campo de espectroscopia fotoelectrónica. La teoría del fotoelectrón de Einstein presentó una manera completamente diferente de medir la constante de Planck que la radiación de cuerpo negro.
La función de trabajo (Φ)
La función de trabajo es una propiedad intrínseca del metal. Si bien las funciones de trabajo y las energías de ionización aparecen como conceptos similares, son independientes. La función de trabajo de un metal es la cantidad mínima de energía (\(\ce{E}\)) necesaria para eliminar un electrón de la superficie del metal a granel (sólido) (a veces denominado energía de unión).
\[\ce{M (s) + \Phi \rightarrow M^{+}(s) + e^{-}}(\text{free with no kinetic energy}) \nonumber \]
La función de trabajo es cualitativamente similar a la energía de ionización (\(\ce{IE}\)), que es la cantidad de energía requerida para eliminar un electrón de un átomo o molécula en estado gaseoso.
\[\ce{M (g) + IE \rightarrow M^{+}(g) + e^{-}} (\text{free with no kinetic energy}) \nonumber \]
Sin embargo, estas dos energías difieren en magnitud (Tabla 1.3.1 ). Por ejemplo, el cobre tiene una función de trabajo de aproximadamente 4.7 eV, pero tiene una mayor energía de ionización de 7.7 eV. Generalmente, las energías de ionización para los metales son mayores que las correspondientes funciones de trabajo (es decir, los electrones están menos unidos en el metal a granel).
| Element | función de trabajo\(\Phi\) (eV) | Energía de ionización (eV) |
|---|---|---|
| Cobre (Cu) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.7 | 7.7 |
| Plata (Ag) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.72 | 7.57 |
| Aluminio (Al) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.20 | 5.98 |
| Oro (Au) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">5.17 | 9.22 |
| Boro (B) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.45 | 8.298 |
| Berilio (Be) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.98 | 9.32 |
| Bismuto (Bi) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.34 | 7.29 |
| Carbono (C) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">5.0 | 11.26 |
| Cesio (Cs) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">1.95 | 3.89 |
| Hierro (Fe) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.67 | 7.87 |
| Galio (Ga) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.32 | 5.99 |
| (Hg) líquido | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.47 | 10.43 |
| Sodio (Na) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">2.36 | 5.13 |
| Litio (Li) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">2.93 | 5.39 |
| Potasio | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">2.3 | 4.34 |
| Selenio (Se) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">5.9 | 9.75 |
| Silicio (Si) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.85 | 8.15 |
| Estaño (Sn) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">4.42 | 7.34 |
| Germanio (Ge) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">5.0 | 7.89 |
| Arsénico (As) | \ (\ Phi\) (eV)” style="text-align:center;” class="lt-chem-13383">3.75 | 9.81 |
- ¿Cuál es la energía en julios y electrón-voltios de un fotón de luz violeta de 420 nm?
- ¿Cuál es la energía cinética máxima de los electrones expulsados del calcio por la luz violeta de 420 nm, dado que la función de trabajo para el metal de calcio es de 2.71 eV?
Estrategia
Para resolver la parte (a), tenga en cuenta que la energía de un fotón viene dada por\(E=h\nu\). Para la parte (b), una vez calculada la energía del fotón, es una aplicación sencilla de la Ecuación\ ref {Eq1} para encontrar la energía cinética máxima del electrón expulsado, ya que\(\Phi\) se da.
Solución para (a)
La energía fotónica viene dada por
\[E = h\nu \nonumber \]
Dado que se nos da la longitud de onda en lugar de la frecuencia, resolvemos la relación familiar\(c=\nu\lambda\) para la frecuencia, cediendo
\[\nu=\dfrac{c}{\lambda} \nonumber \]
Combinar estas dos ecuaciones da la relación útil
\[E=\dfrac{hc}{\lambda} \nonumber \]
Ahora sustituyendo rendimientos de valores conocidos
\[\begin{align*} E &= \dfrac{(6.63 \times 10^{-34}\; J \cdot s)(3.00 \times 10^8 m/s)}{420 \times 10^{-9}\; m} \\[4pt] &= 4.74 \times 10^{-19}\; J \end{align*} \nonumber \]
Convertiéndose a eV, la energía del fotón es
\[\begin{align*} E&=(4.74 \times 10^{-19}\; J) \left( \dfrac{1 \;eV}{1.6 \times 10^{-19}\;J} \right) \\[4pt] &= 2.96\; eV. \nonumber \end{align*} \nonumber \]
Solución para (b)
Encontrar la energía cinética del electrón expulsado es ahora una simple aplicación de la Ecuación\ ref {Eq1}. Sustitución de los rendimientos de energía fotónica y energía de unión
\[\begin{align*} KE_e &=h\nu – \Phi \\[4pt] &= 2.96 \;eV – 2.71 \;eV \\[4pt] &= 0.246\; eV.\nonumber \end{align*} \nonumber \]
Discusión
La energía de este fotón de 420 nm de luz violeta es una pequeña fracción de un joule, por lo que no es de extrañar que un solo fotón nos sea difícil de percibir directamente, los humanos están más en sintonía con las energías del orden de los julios. Pero mirando la energía en electrón-voltios, podemos ver que este fotón tiene suficiente energía para afectar átomos y moléculas. Una molécula de ADN se puede romper con aproximadamente 1 eV de energía, por ejemplo, y las energías atómicas y moleculares típicas son del orden de eV, de modo que el fotón UV en este ejemplo podría tener efectos biológicos.
El electrón expulsado (llamado fotoelectrón) tiene una energía bastante baja, y no viajaría lejos, excepto en un vacío. El electrón sería detenido por un potencial retardador de 0.26 eV. De hecho, si la longitud de onda del fotón fuera más larga y su energía menor a 2.71 eV, entonces la fórmula daría una energía cinética negativa, una imposibilidad. Esto simplemente significa que los fotones de 420 nm con su energía de 2.96-eV no están muy por encima del umbral de frecuencia. Puedes demostrar por ti mismo que la longitud de onda umbral es de 459 nm (luz azul). Esto significa que si se usa metal calcio en un medidor de luz, el medidor será insensible a longitudes de onda más largas que las de la luz azul. Un medidor de luz de este tipo sería insensible a la luz roja, por ejemplo.
¿Cuál es la radiación electromagnética de longitud de onda más larga que puede expulsar un fotoelectrón de la plata? ¿Está esto en el rango visible?
- Contestar
-
Dado que la función de trabajo es 4.72 eV de la Tabla 1.3.1 , entonces solo los fotones con longitudes de onda inferiores a 263 nm inducirán fotoelectrones (calculados vía\(E=h \nu\)). Esto es ultravioleta y no en el rango visible.
¿Por qué la función de trabajo de un elemento generalmente es menor que la energía de ionización de ese elemento?
- Contestar
-
La función de trabajo de un metal se refiere a la energía mínima requerida para extraer un electrón de la superficie de un metal (a granel) por la absorción de un fotón de luz. La función de trabajo variará de metal a metal. En contraste, la energía de ionización es la energía necesaria para separar los electrones de los átomos y también varía con cada átomo en particular, con la valencia los electrones requieren menos energía para extraer que los electrones centrales (es decir, de las conchas inferiores) que están más estrechamente ligados a los núcleos. Los electrones en la red metálica allí están menos unidos (es decir, libres para moverse dentro del metal) y eliminar uno de estos electrones es mucho más fácil que eliminar un electrón de un átomo porque los enlaces metálicos del metal a granel reducen su energía de unión. Como mostraremos en capítulos posteriores, cuanto más deslocalizada esté una partícula, menor será su energía.
Resumen
Si bien Hertz descubrió el fotoelectrón en 1887, no fue hasta 1905 cuando se propuso una teoría que explicaba completamente el efecto. La teoría fue propuesta por Einstein e hizo la afirmación de que la radiación electromagnética tenía que ser pensada como una serie de partículas, llamadas fotones, que chocan con los electrones en la superficie y los emiten. Esta teoría iba en contra de la creencia de que la radiación electromagnética era una onda y por lo tanto no se reconoció como correcta hasta 1916 cuando Robert Millikan confirmó experimentalmente la teoría
El efecto fotoeléctrico es el proceso en el que la radiación electromagnética expulsa electrones de un material. Einstein propuso que los fotones fueran cuantos de radiación electromagnética teniendo energía\(E=h\nu\) es la frecuencia de la radiación. Toda la radiación electromagnética está compuesta por fotones. Como explicó Einstein, todas las características del efecto fotoeléctrico se deben a la interacción de fotones individuales con electrones individuales. La energía cinética máxima\(KE_e\) de los electrones expulsados (fotoelectrones) viene dada por\(KE_e=h\nu – \Phi\), donde\(h\nu\) está la energía fotónica y\(\Phi\) es la función de trabajo (o energía de unión) del electrón al material particular.
Preguntas Conceptuales
- ¿Es la luz visible el único tipo de radiación electromagnética que puede causar el efecto fotoeléctrico?
- ¿Qué aspectos del efecto fotoeléctrico no se pueden explicar sin fotones? ¿Cuál se puede explicar sin fotones? ¿Estos últimos son inconsistentes con la existencia de fotones?
- ¿Es el efecto fotoeléctrico una consecuencia directa del carácter de onda de la radiación electromagnética o del carácter de partícula de la radiación electromagnética? Explique brevemente.
- Los aislantes (no metales) tienen una\(\Phi\) mayor que los metales, y es más difícil para los fotones expulsar electrones de los aisladores. Discutir cómo esto se relaciona con los cargos libres en los metales que los convierten en buenos conductores.
- Si coges y sacudes un trozo de metal que tiene electrones en él libres para moverse como corriente, no se caen electrones. Sin embargo, si calientas el metal, los electrones pueden ser hervidos. Explique ambos hechos en la medida en que se relacionan con la cantidad y distribución de energía involucrada con sacudir el objeto en comparación con calentarlo.
Colaboradores y Atribuciones
Michael Fowler (Beams Professor, Department of Physics, University of Virginia)
Adapted from "Quantum States of Atoms and Molecules" by David M. Hanson, Erica Harvey, Robert Sweeney, Theresa Julia Zielinski
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).

