1.4: El espectro atómico del hidrógeno
- Page ID
- 79484
- Introducir el concepto de espectros de líneas de absorción y emisión y describir la ecuación de Balmer para describir las líneas visibles de hidrógeno atómico.
El primero en darse cuenta de que la luz blanca estaba conformada por los colores del arco iris fue Isaac Newton, quien en 1666 pasó la luz del sol a través de una estrecha hendidura, luego un prisma, para proyectar el espectro coloreado sobre una pared. Este efecto se había notado previamente, claro, no menos importante en el cielo, pero los intentos previos de explicarlo, por Descartes y otros, habían sugerido que la luz blanca se coloreaba cuando se refractaba, el color dependiendo del ángulo de refracción. Newton aclaró la situación utilizando un segundo prisma para reconstituir la luz blanca, haciendo mucho más plausible la idea de que la luz blanca estaba compuesta por los colores separados. Luego tomó un componente monocromático del espectro generado por un prisma y lo pasó por un segundo prisma, estableciendo que no se generaron más colores. Es decir, la luz de un solo color no cambió de color en la refracción. Concluyó que la luz blanca estaba conformada por todos los colores del arco iris, y que al pasar por un prisma, estos diferentes colores se refractaron a través de ángulos ligeramente diferentes, separándolos así en el espectro observado.
Espectros de Línea Atómica
El espectro de los átomos de hidrógeno, que resultó ser crucial para proporcionar la primera visión de la estructura atómica más de medio siglo después, fue observado por primera vez por Anders Ångström en Uppsala, Suecia, en 1853. Su comunicación fue traducida al inglés en 1855. Ångström, hijo de un ministro de país, era una persona reservada, no interesada en la vida social que se centraba en torno a la corte. En consecuencia, pasaron muchos años antes de que sus logros fueran reconocidos, en su país o en el extranjero (la mayoría de sus resultados fueron publicados en sueco).
La mayor parte de lo que se sabe sobre la estructura y mecánica atómica (y molecular) se ha deducido de la espectroscopia. La figura 1.4.1 muestra dos tipos diferentes de espectros. Un espectro continuo puede ser producido por un sólido incandescente o gas a alta presión (por ejemplo, la radiación de cuerpo negro es un continuo). Un espectro de emisión puede ser producido por un gas a baja presión excitado por calor o por colisiones con electrones. Un espectro de absorción resulta cuando la luz de una fuente continua pasa a través de un gas más frío, que consiste en una serie de líneas oscuras características de la composición del gas.
En 1802, William Wollaston en Inglaterra había descubierto que el espectro solar tenía pequeñas brechas: había muchas líneas oscuras delgadas en el arco iris de colores. Estos fueron investigados de manera mucho más sistemática por Joseph von Fraunhofer, a partir de 1814. Aumentó la dispersión mediante el uso de más de un prisma. Encontró un “número casi incontable” de líneas. Marcó las líneas oscuras más fuertes A, B, C, D, etc. Frauenhofer entre 1814 y 1823 descubrió cerca de 600 líneas oscuras en el espectro solar vistas a alta resolución y designó las características principales con las letras A a K, y líneas más débiles con otras letras (Tabla 1.4.1 ). Las observaciones modernas de la luz solar pueden detectar muchos miles de líneas. Ahora se entiende que estas líneas son causadas por la absorción por las capas externas del Sol.
| Designación | Element | Longitud de onda (nm) |
|---|---|---|
| y | O 2 | 898.765 |
| Z | O 2 | 822.696 |
| A | O 2 | 759.370 |
| B | O 2 | 686.719 |
| C | H | 656.281 |
| a | O 2 | 627.661 |
| D 1 | Na | 589.592 |
| D 2 | Na | 588.995 |
| D 3 o d | Él | 587.5618 |
Las líneas de Fraunhofer son líneas típicas de absorción espectral. Estas líneas oscuras se producen siempre que un gas frío se encuentre entre una fuente de fotones de amplio espectro y el detector. En este caso, se observa una disminución en la intensidad de la luz en la frecuencia del fotón incidente a medida que los fotones son absorbidos, luego reemitidos en direcciones aleatorias, que en su mayoría se encuentran en direcciones diferentes a la original. Esto da como resultado una línea de absorción, ya que la estrecha banda de frecuencia de la luz que inicialmente viaja hacia el detector, ha sido convertida en calor o reemitida en otras direcciones.
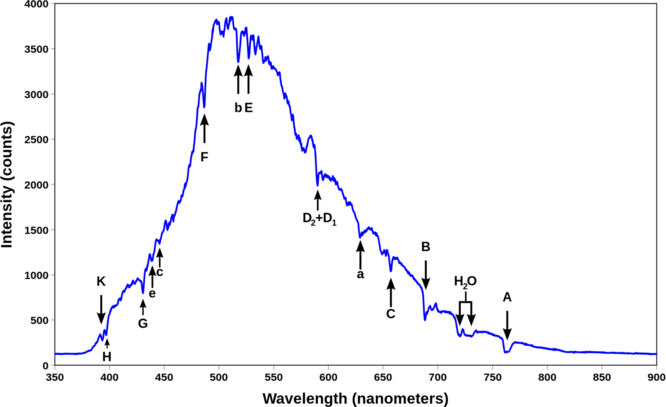
Por el contrario, si el detector ve fotones emitidos directamente por un gas brillante, entonces el detector a menudo ve fotones emitidos en un rango de frecuencia estrecho por procesos de emisión cuántica en átomos en el gas caliente, lo que resulta en una línea de emisión. En el Sol, las líneas de Fraunhofer se ven a partir del gas en las regiones exteriores del Sol, que son demasiado frías para producir directamente líneas de emisión de los elementos que representan.
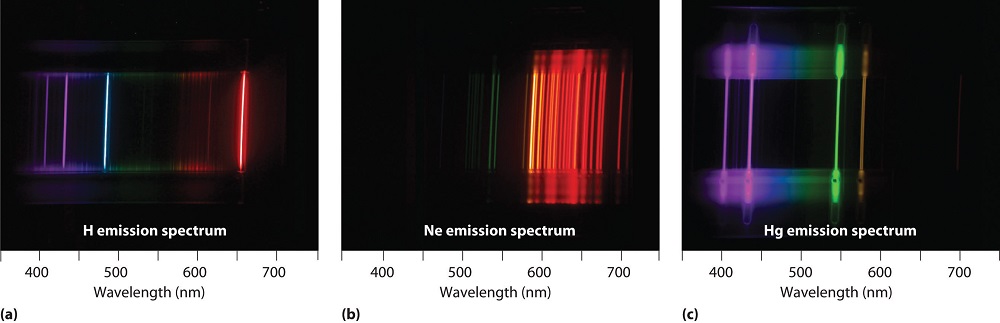
Bunsen, Kirkhoff y otros encontraron gases calentados a incandescencia que emitían luz con una serie de longitudes de onda agudas. La luz emitida analizada por un espectrómetro (o incluso un simple prisma) aparece como una multitud de bandas estrechas de color. Estos llamados espectros de línea son característicos de la composición atómica del gas. Los espectros de líneas de varios elementos se muestran en la Figura 1.4.3 .
La serie Balmer de hidrógeno
Obviamente, si se pudiera discernir algún patrón en las líneas espectrales para un átomo específico (en contraposición a la mezcla que representan las líneas de Fraunhofer), eso podría ser una pista sobre la estructura interna del átomo. Uno podría ser capaz de construir un modelo. Un gran esfuerzo fue analizar los datos espectrales a partir de la década de 1860. El gran avance lo logró Johann Balmer, profesor de matemáticas y latín en una escuela de niñas en Basilea, Suiza. Balmer no había hecho física antes e hizo su gran descubrimiento cuando tenía casi sesenta años.
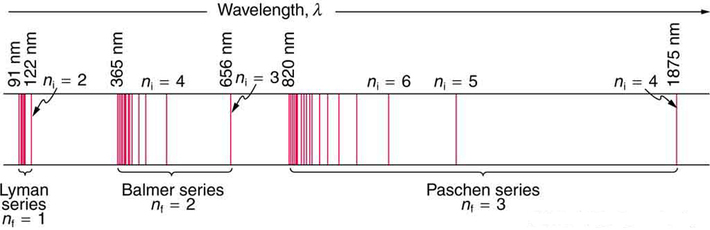
Balmer decidió que el átomo más probable para mostrar patrones espectrales simples era el átomo más ligero, el hidrógeno. Ångström había medido las cuatro líneas espectrales visibles para tener longitudes de onda 656.21, 486.07, 434.01 y 410.12 nm (Figura 1.4.4 ). Balmer se concentró solo en estos cuatro números, y encontró que estaban representados por la fórmula fenomenológica:
\[\lambda = b \left( \dfrac{n_2^2}{n_2^2 -4} \right) \label{1.4.1} \]
donde\(b\) = 364.56 nm y\(n_2 = 3, 4, 5, 6\).
Las primeras cuatro longitudes de onda de la Ecuación\(\ref{1.4.1}\) (con\(n_2\) = 3, 4, 5, 6) estuvieron en excelente acuerdo con las líneas experimentales de Ångström (Tabla 1.4.2 ). Balmer predijo que existen otras líneas en el ultravioleta que corresponden\(n_2 \ge 7\) y de hecho ya se habían observado algunas de ellas, sin que Balmer lo supiera.
| \(n_2\) | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|
| \ (n_2\)” alcance="fila">\(\lambda\) | 656 | 486 | 434 | 410 | 397 | 389 | 383 | 380 |
| \ (n_2\)” scope="fila">color | rojo | verde azulado | azul | índigo | violeta | no visible | no visible | no visible |
El\(n_2\) número entero en la serie Balmer se extiende teóricamente hasta el infinito y la serie representa una energía (y frecuencia) monótonamente crecientes de las líneas de absorción con\(n_2\) valores crecientes. Además, la diferencia de energía entre líneas sucesivas disminuyó a medida que\(n_2\) aumenta (1.4.4 ). Este comportamiento converge a una energía más alta posible como lo demuestra el Ejemplo 1.4.1 . Si las líneas se trazan de acuerdo a sus\(\lambda\) en una escala lineal, obtendrá la apariencia del espectro en la Figura 1.4.4 ; estas líneas se llaman la serie Balmer.
La fórmula general de Balmer (Ecuación\(\ref{1.4.1}\)) se puede reescribir en términos de la longitud de onda inversa típicamente llamada número de onda (\(\widetilde{\nu}\)).
\[ \begin{align} \widetilde{\nu} &= \dfrac{1}{ \lambda} \\[4pt] &=R_H \left( \dfrac{1}{4} -\dfrac{1}{n_2^2}\right) \label{1.4.2} \end{align} \]
donde\(n_2 = 3, 4, 5, 6\) y\(R_H\) es la constante de Rydberg (discutida en la siguiente sección) igual a 109,737 cm -1.
Conjeturó además que el 4 podría ser sustituido por 9, 16, 25,... y esto también resultó ser cierto -pero estas líneas, más hacia el infrarrojo, no se detectaron hasta principios del siglo XX, junto con las líneas ultravioletas.
La relación entre la longitud de onda y la frecuencia para la radiación electromagnética es
\[\lambda \nu= c \nonumber \]
En el sistema SI de unidades la longitud de onda, (\(\lambda\)) se mide en metros (m) y dado que las longitudes de onda suelen ser muy pequeñas se suele utilizar el nanómetro (nm) que es\(10^{-9}\; m\). La frecuencia (\(\nu\)) en el sistema SI se mide en segundos recíprocos 1/s − que se llama Hertz (después del descubrimiento del efecto fotoelectrónico) y se representa por Hz.
Es común utilizar el recíproco de la longitud de onda en centímetros como medida de la frecuencia de radiación. Esta unidad se llama número de onda y se representa por (\(\widetilde{\nu}\)) y se define por
\[ \begin{align*} \widetilde{\nu} &= \dfrac{1}{ \lambda} \\[4pt] &= \dfrac{\nu}{c} \end{align*} \nonumber \]
Ondulenumbers es una unidad conveniente en espectroscopía porque es directamente proporcional a la energía.
\[ \begin{align*} E &= \dfrac{hc}{\lambda} \nonumber \\[4pt] &= hc \times \dfrac{1}{\lambda} \nonumber \\[4pt] &= hc\widetilde{\nu} \label{energy} \\[4pt] &\propto \widetilde{\nu} \end{align*} \]
Calcular las longitudes de onda más largas y cortas (en nm) emitidas en la serie Balmer del espectro de emisión de átomos de hidrógeno.
Solución
A partir del comportamiento de la ecuación de Balmer (Ecuación\(\ref{1.4.1}\) y Tabla 1.4.2 ), el valor de\(n_2\) que da la longitud de onda más larga (es decir, mayor\(\lambda\)) () es el valor más pequeño posible de\(n_2\), que es (\(n_2\)=3) para esta serie. Esto da como resultado
\[ \begin{align*} \lambda_{longest} &= (364.56 \;nm) \left( \dfrac{9}{9 -4} \right) \\[4pt] &= (364.56 \;nm) \left( 1.8 \right) \\[4pt] &= 656.2\; nm \end{align*} \nonumber \]
Esto también se conoce como la\(H_{\alpha}\) línea de hidrógeno atómico y es de color rojo brillante (Figura\(\PageIndex{3a}\)).
Para la longitud de onda más corta, se debe reconocer que la longitud de onda más corta (mayor energía) se obtiene en el límite de mayor (\(n_2\)):
\[ \lambda_{shortest} = \lim_{n_2 \rightarrow \infty} (364.56 \;nm) \left( \dfrac{n_2^2}{n_2^2 -4} \right) \nonumber \]
Esto se puede resolver a través de la Regla de L'Hôpital, o alternativamente el límite se puede expresar a través de la expresión energética igualmente útil (Ecuación\ ref {1.4.2}) y simplemente resolverse:
\[ \begin{align*} \widetilde{\nu}_{greatest} &= \lim_{n_2 \rightarrow \infty} R_H \left( \dfrac{1}{4} -\dfrac{1}{n_2^2}\right) \\[4pt] &= \lim_{n_2 \rightarrow \infty} R_H \left( \dfrac{1}{4}\right) \\[4pt] &= 27,434 \;cm^{-1} \end{align*} \nonumber \]
Ya que\( \dfrac{1}{\widetilde{\nu}}= \lambda\) en unidades de cm, esto se convierte a 364 nm como la longitud de onda más corta posible para la serie Balmer.
La serie Balmer es particularmente útil en astronomía porque las líneas de Balmer aparecen en numerosos objetos estelares debido a la abundancia de hidrógeno en el universo, y por lo tanto son comúnmente vistas y relativamente fuertes en comparación con líneas de otros elementos.
Colaboradores y Atribuciones
Michael Fowler (Beams Professor, Department of Physics, University of Virginia)

