9.2: Las especies prototípicas de H2+
- Page ID
- 79838
La teoría orbital molecular es una extensión conceptual del modelo orbital, que se aplicó con tanto éxito a la estructura atómica. Como alguna vez se comentó juguetonamente, “una molécula no es más que un átomo con más núcleos”. Esto puede ser demasiado simplista, pero sí intentamos, en la medida de lo posible, explotar analogías con la estructura atómica. Nuestra comprensión de los orbitales atómicos comenzó con las soluciones exactas de un problema prototipo: el átomo de hidrógeno. Comenzaremos nuestro estudio de moléculas diatómicas homonucleares comenzando con otro prototipo exactamente solucionable, la molécula de hidrógeno-ion\(\ce{H2^{+}}\).
El ion molecular de hidrógeno
La molécula más simple concebible estaría compuesta por dos protones y un electrón, a saber\(\ce{H2^{+}}\). Esta especie en realidad tiene una existencia transitoria en descargas eléctricas a través del gas hidrógeno y ha sido detectada por espectrometría de masas y también se ha detectado en el espacio exterior. La ecuación de Schrödinger para se\(\ce{H2^{+}}\) puede resolver exactamente dentro de la aproximación Born-Oppenheimer (es decir, núcleos fijos). Este ion consiste en dos protones unidos por la fuerza electrostática de un solo electrón. Claramente los dos protones, dos cargas positivas, se derogan entre sí. Los protones deben mantenerse unidos por una atractiva fuerza Coulomb que se oponga a la repulsiva fuerza Coulomb. Una densidad de carga negativa entre los dos protones produciría la fuerza requerida de Coulomb de contrarrestar necesaria para unir los protones. De manera intuitiva, para crear un enlace químico entre dos protones o dos núcleos cargados positivamente, se necesita una alta densidad de carga negativa entre ellos. Esperamos que los orbitales moleculares que encontramos reflejen esta noción intuitiva.
El Hamiltoniano electrónico para\(\ce{H2^{+}}\) es
\[\hat {H}_{elec} (r, R) = -\dfrac {\hbar ^2}{2m} \nabla ^2 - \dfrac {e^2}{4 \pi \epsilon _0 r_A} - \dfrac {e^2}{4 \pi \epsilon _0 r_B} + \dfrac {e^2}{4 \pi \epsilon _0 R} \label{9.2.1} \]
donde\(r_A\) y\(r_B\) son las distancias electrón de los núcleos\(A\) e\(B\) hidrógeno, respectivamente y\(R\) es la distancia entre los dos protones.
Si bien la ecuación de Schrödinger para\(\ce{H2^{+}}\) puede resolverse exactamente (aunque dentro de la aproximación Born-Oppenheimer donde se fijan los núcleos) porque solo hay un electrón, desarrollaremos soluciones aproximadas de una manera aplicable a otras moléculas diatómicas que tengan más de un electrón.
Combinación Lineal de Orbitales Atómicos
Para el caso donde los protones en H 2 + están infinitamente separados, tenemos un átomo de hidrógeno y un protón aislado cuando el electrón está cerca de un protón u otro. La función de onda electrónica solo sería\(1s_A(r)\) o\(1s_B(r)\) dependiendo de qué protón, etiquetado\(A\) o\(B\), el electrón está cerca. Aquí\(1s_A\) denota un orbital atómico de hidrógeno 1s con protón A que sirve como origen del sistema de coordenadas polares esféricas en el que se especifica la posición\(r\) del electrón. De igual manera\(1s_B\) tiene el protón B como origen. Una aproximación útil para el orbital molecular cuando los protones están muy juntos es, por lo tanto, una combinación lineal de los dos orbitales atómicos. El método general de uso
\[\psi (r) = C_A 1s_A (r) + C_B1s_B (r) \label{9.2.2} \]
es decir, de encontrar orbitales moleculares como combinaciones lineales de orbitales atómicos se llama el Método de Combinación Lineal de Orbitales Atómicos - Orbitales Moleculares (LCAO-MO). En este caso tenemos dos funciones básicas en nuestro conjunto de bases, los orbitales atómicos hidrogénicos\(1s_A\) y\(1s_B\).
La aproximación LCAO es un ejemplo del método variacional lineal discutido previamente con la verdadera función de onda orbital molecular aproximada como una expansión de un conjunto base de orbitales atómicos en cada átomo de la molécula con coeficientes variables que pueden ser optimizados (por ejemplo, a través de las ecuaciones seculares). Como se discutió anteriormente, el número de funciones de onda (soluciones) extraídas de la resolución del determinante secular es igual al número de elementos en la expansión. Así que para la expansión en la Ecuación\ ref {9.2.2} con dos orbitales atómicos que aportan resultado en dos orbitales moleculares.
Este método produce una imagen aproximada de los orbitales moleculares en una molécula. La siguiente figura muestra dos átomos aproximándose a lo largo del eje de uno de sus\(2p\) estados. En la fila superior, los dos lóbulos enfrentados entre sí tienen el mismo signo; en la fila inferior tienen signo opuesto. Se trata de dos combinaciones lineales diferentes de los mismos dos estados atómicos, en diferentes átomos y con fases de diferencia (es decir, signos de\(C_A\) vs\(C_B\) en la expansión). En el primer ejemplo, la densidad de electrones aumenta entre los núcleos y en el segundo ejemplo, un nodo de lados muy empinados entre los dos núcleos hace que toda la densidad de probabilidad quede alejada del átomo opuesto.

Para\(\ce{H2^{+}}\), la molécula más simple, la función de partida viene dada por Ecuación\(\ref{9.2.2}\). Debemos determinar los valores para los coeficientes,\(C_A\) y\(C_B\). Podríamos usar el método variacional para encontrar un valor para estos coeficientes, pero para el caso de\(\ce{H2^{+}}\) evaluar estos coeficientes es fácil. Dado que los dos protones son idénticos, la probabilidad de que el electrón esté cerca\(A\) debe ser igual a la probabilidad de que el electrón esté cerca\(B\). Estas probabilidades están dadas por\(|C_A|^2\) y\(|C_B|^2\), respectivamente. Considerar dos posibilidades que satisfagan la condición\(|C_A|^2 = |C_B|^2\); a saber,\(C_A = C_B = C_{+}\) y\(C_A = -C_B = C_{-}\). Estos dos casos producen dos orbitales moleculares:
\[\psi _+ = C_+(1s_A + 1s_B) \label{9.2.3a} \]
\[\psi _{-} = C_{-}(1s_A - 1s_B) \label{9.2.3b} \]
La densidad de probabilidad para encontrar el electrón en cualquier punto del espacio viene dada por\(|{\psi}^2|\) y la densidad de carga electrónica es justa\(|e{\psi}^2|\). La diferencia importante entre\(\psi _+\) y\(\psi _{-}\) es que la densidad de carga para\(\psi _+\) se mejora (Figura 9.2.2 (abajo) entre los dos protones, mientras que se disminuye para\(\psi _{-}\) como se muestra en las Figuras 9.2.2 (arriba). \(\psi _{-}\)tiene un nodo en el medio mientras que\(\psi _+\) corresponde a nuestro sentido intuitivo de cómo debe ser un enlace químico. La densidad de carga electrónica se mejora en la región entre los dos protones.
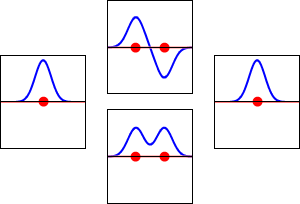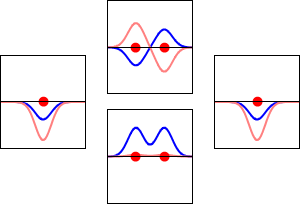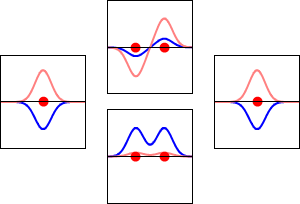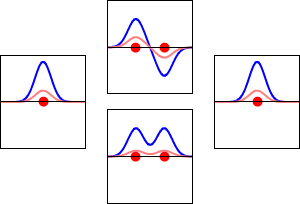
Así\(\psi _+\) se llama un orbital molecular de unión. Si el electrón fuera descrito por\(\psi _{-}\), la baja densidad de carga entre los dos protones no equilibraría la repulsión Coulomb de los protones, por lo que\(\psi _{-}\) se denomina orbital molecular antienlace.
Colaboradores y Atribuciones
Adapted from "Quantum States of Atoms and Molecules" by David M. Hanson, Erica Harvey, Robert Sweeney, Theresa Julia Zielinski
- Rudolf Winter (Aberystwyth University)

