9.7: Orbitales Moleculares Pueden Ordenarse Según Sus Energías
- Page ID
- 79904
El método LCAO-MO que usamos para H 2 + se puede aplicar cualitativamente a moléculas diatómicas homonucleares para proporcionar información adicional sobre la unión química. Un enfoque más cuantitativo también es útil, especialmente para situaciones más complicadas, como moléculas diatómicas heteronucleares y moléculas poliatómicas. Cuando dos átomos están lo suficientemente cerca como para que sus orbitales de valencia se superpongan significativamente, las capas internas de electrones rellenas no se perturban en gran medida; por lo tanto, a menudo se ignoran en la construcción de orbitales moleculares. Esto significa que podemos centrar nuestra atención en los orbitales moleculares derivados de orbitales atómicos de valencia.
Orbitales moleculares formados a partir de orbitales ns
Los diagramas orbitales moleculares formateados para las especies de dihidrógeno son similares a los diagramas a cualquier molécula diatómica homonuclear con dos átomos idénticos de metal alcalino (Li 2 y Cs 2, por ejemplo) se muestra en la parte (a) en la Figura 9.7.1 , donde M representa el átomo de metal. Solo dos niveles de energía son importantes para describir los orbitales moleculares de electrones de valencia de estas especies: un orbital molecular de enlace σ ns y un orbital molecular antienlace σ * ns. Debido a que cada metal alcalino (M) tiene una configuración de electrones de valencia ns 1, la molécula M 2 tiene dos electrones de valencia que llenan el orbital de enlace σ ns. Como resultado, se predice un orden de enlace de 1 para todas las especies diatómicas homonucleares formadas a partir de los metales alcalinos (Li 2, Na 2, K 2, Rb 2 y Cs 2). Las características generales de estos diagramas M 2 son idénticas al diagrama de la molécula H 2. Experimentalmente, se encuentra que todos son estables en la fase gaseosa, y algunos incluso son estables en solución.
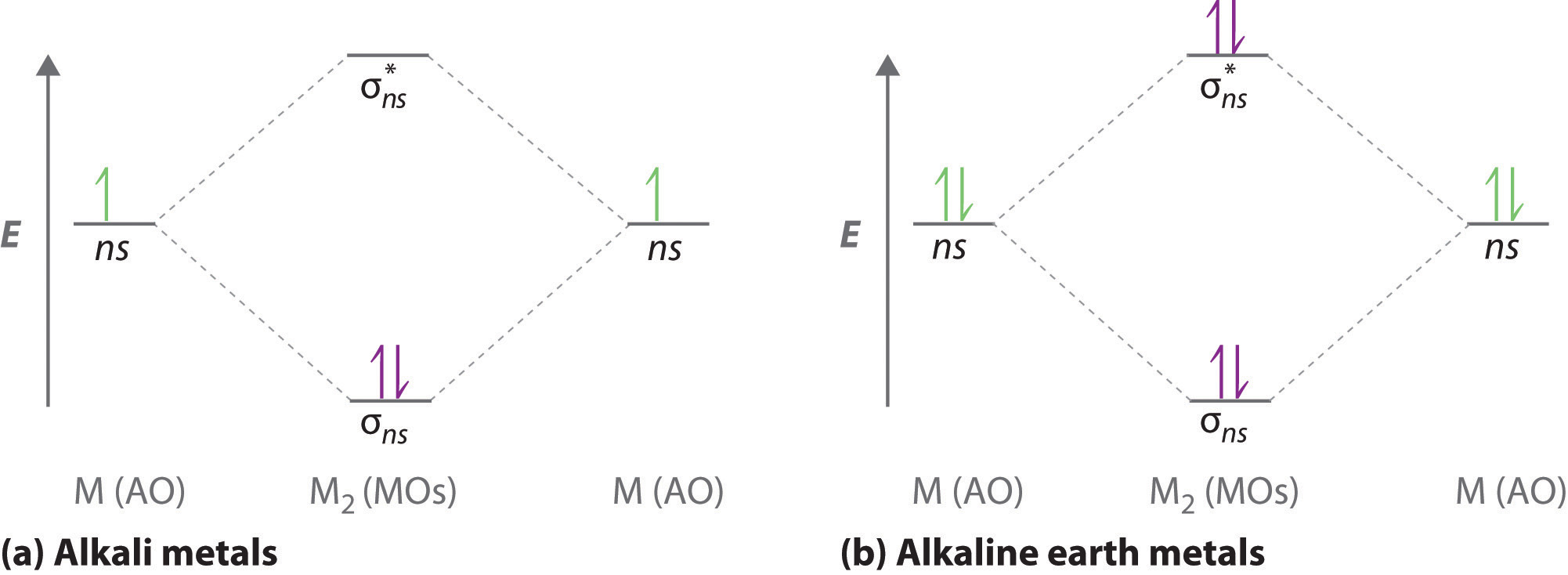
De igual manera, los diagramas orbitales moleculares para compuestos diatómicos homonucleares de los metales alcalinotérreos (como Be 2), en los que cada átomo metálico tiene una configuración de electrones de valencia ns 2, se asemejan al diagrama para la molécula He 2. Como se muestra en la Figura\(\PageIndex{1b}\), éste es efectivamente el caso. Todas las moléculas diatómicas homonucleares alcalinotérreas tienen cuatro electrones de valencia, los cuales llenan tanto el orbital de unión σ ns como el orbital σ ns * antienlace y dan un orden de enlace de 0. Por lo tanto, se espera que Be 2, Mg 2, Ca 2, Sr 2 y Ba 2 sean inestables, de acuerdo con los datos experimentales. En estado sólido, sin embargo, todos los metales alcalinos y los metales alcalinotérreos existen como celosías extendidas unidas por unión metálica. A bajas temperaturas,\(Be_2\) es st capaz.
Utilice un diagrama cualitativo de nivel de energía orbital molecular para predecir la configuración del electrón de valencia, el orden de enlace y la probable existencia del ion Na 2 −.
Dado: especies químicas
Preguntado por: diagrama de nivel de energía orbital molecular, configuración de electrones de valencia, orden de enlace y estabilidad
Estrategia
- Combine los dos orbitales atómicos de valencia sódica para producir orbitales moleculares ligantes y antiaglutinantes. Dibuje el diagrama de nivel de energía orbital molecular para este sistema.
- Determinar el número total de electrones de valencia en el ion Na 2 −. Llenar los orbitales moleculares en el diagrama de nivel de energía comenzando por el orbital con la energía más baja. Asegúrate de obedecer el principio Pauli y la regla de Hund mientras lo haces.
- Calcular el orden de enlace y predecir si la especie es estable.
Solución
A Debido a que el sodio tiene una configuración de [Ne] 3 s 1 electrón, el diagrama de nivel de energía orbital molecular es cualitativamente idéntico al diagrama para la interacción de dos orbitales atómicos de 1 s.
B El ion Na 2 − tiene un total de tres electrones de valencia (uno de cada átomo de Na y uno para la carga negativa), dando como resultado un orbital molecular σ 3 s relleno, un σ 3 s medio lleno * y una configuración\( \left ( \sigma _{3s} \right )^{2}\left ( \sigma _{3s}^{\star } \right )^{1} \) electrónica.
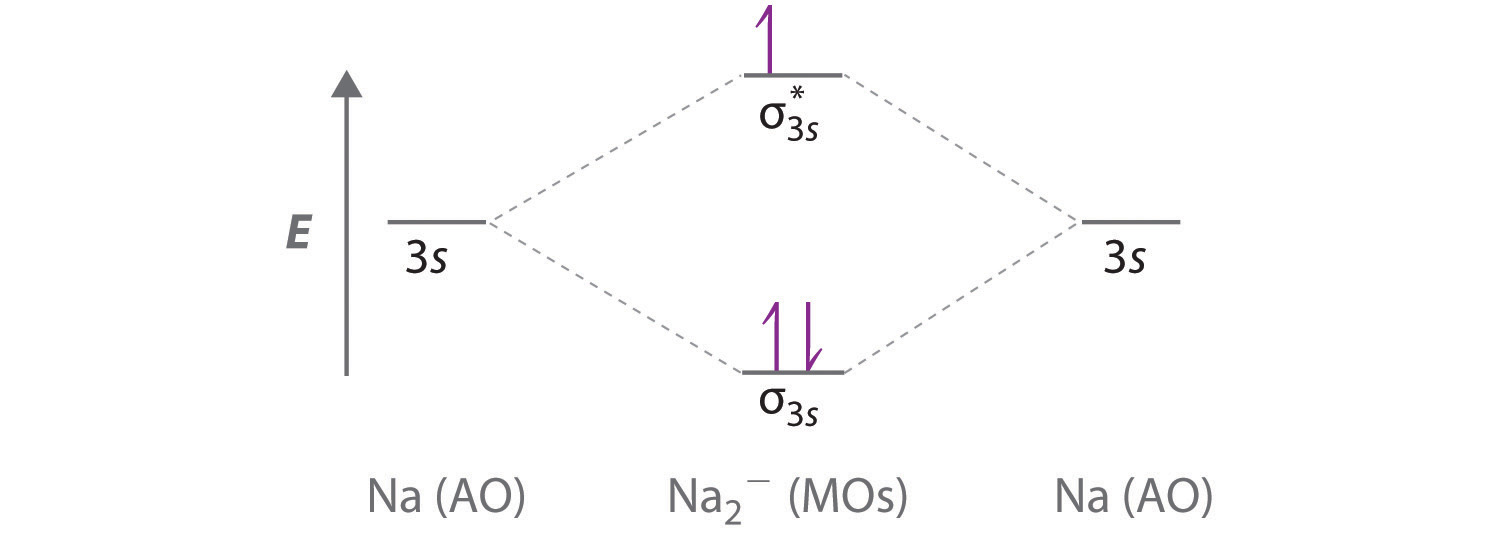
C El orden de enlace es (2-1) ÷ 2=1/2 Con un orden de enlace fraccional, predecimos que el ion Na 2 − existe pero es altamente reactivo.
Utilice un diagrama cualitativo de nivel de energía orbital molecular para predecir la configuración de electrones de valencia, el orden de enlace y la probable existencia del ion Ca 2 +.
- Contestar
-
Ca 2 + tiene configuraciones de\( \left ( \sigma _{4s} \right )^{2}\left ( \sigma _{4s}^{\star } \right )^{1} \) electrones y un orden de enlace de 1/2 y debe existir.
Orbitales moleculares formados a partir de orbitales n p
Orbitales atómicos distintos de los orbitales ns también pueden interactuar para formar orbitales moleculares. Debido a que los orbitales p, d y f individuales no son esféricamente simétricos, sin embargo, necesitamos definir un sistema de coordenadas para saber qué lóbulos interactúan en el espacio tridimensional. Recordemos que para cada subshell np, por ejemplo, hay orbitales np x, np y np z. Todos tienen la misma energía y por lo tanto son degenerados, pero tienen diferentes orientaciones espaciales.
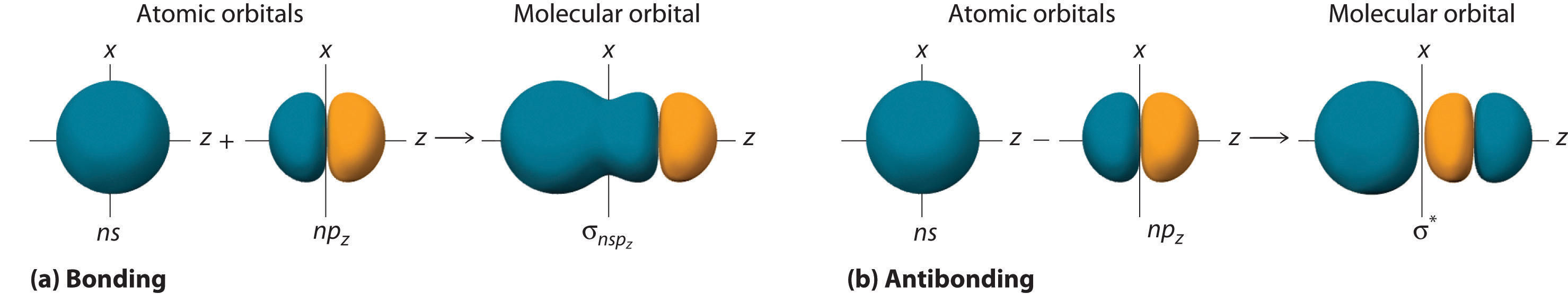
\[ \sigma _{np_{z}}=np_{z}\left ( A \right )-np_{z}\left ( B \right ) \label{9.7.1} \]
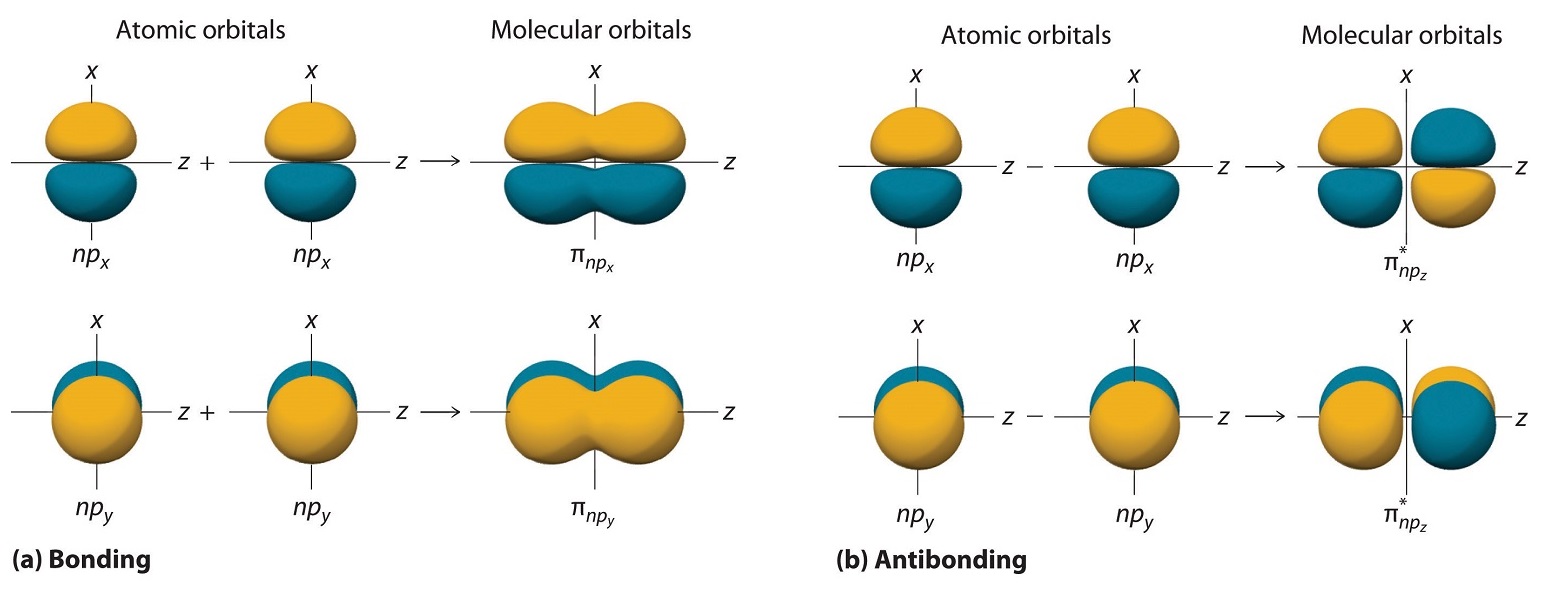
Al igual que con los orbitales ns, podemos formar orbitales moleculares a partir de orbitales np tomando su suma matemática y diferencia. Cuando dos lóbulos positivos con la orientación espacial apropiada se superponen, como se ilustra para dos orbitales atómicos np z en la parte (a) en la Figura 9.7.2 , es la diferencia matemática de sus funciones de onda lo que da como resultado interferencia constructiva, que a su vez aumenta la densidad de probabilidad de electrones entre los dos átomos. Por lo tanto, la diferencia corresponde a un orbital molecular llamado orbital molecular de\( \sigma _{np_{z}} \) enlace porque, al igual que con los orbitales σ discutidos anteriormente, es simétrico alrededor del eje internuclear (en este caso, el eje z):
\[ \sigma _{np_{z}}=np_{z}\left ( A \right )-np_{z}\left ( B \right ) \label{9.7.2} \]
La otra combinación posible de los dos orbitales np z es la suma matemática:
\[ \sigma _{np_{z}}=np_{z}\left ( A \right )+np_{z}\left ( B \right ) \label{9.7.3} \]
En esta combinación, mostrada en la parte (b) en la Figura 9.7.2 , el lóbulo positivo de un orbital atómico np z se solapa con el lóbulo negativo de la otra, conduciendo a la interferencia destructiva de las dos ondas y creando un nodo entre los dos átomos. De ahí que se trate de un orbital molecular antiunión. Debido a que también es simétrico alrededor del eje internuclear, a este orbital molecular se le llama orbital molecular\( \sigma _{np_{z}}=np_{z}\left ( A \right )-np_{z}\left ( B \right ) \) antienlace. Siempre que los orbitales se combinan, la combinación de unión es siempre menor en energía (más estable) que los orbitales atómicos de los que se derivó, y la combinación antiadhesión es mayor en energía (menos estable).
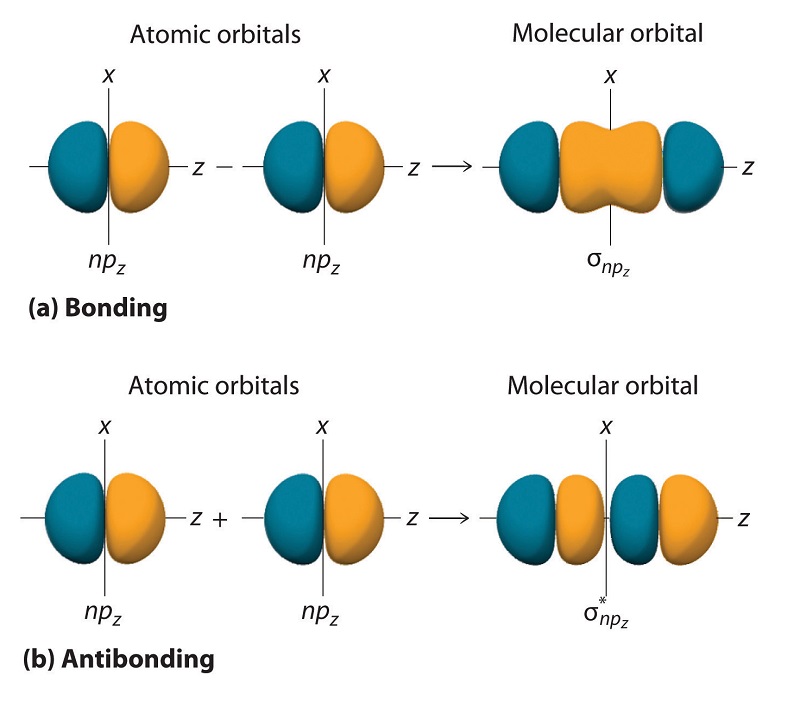
Los orbitales p restantes en cada uno de los dos átomos, np x y np y, no apuntan directamente uno hacia el otro. En cambio, son perpendiculares al eje internuclear. Si etiquetamos arbitrariamente los ejes como se muestra en la Figura 9.7.3 , vemos que tenemos dos pares de orbitales np: los dos orbitales np x que se encuentran en el plano de la página, y dos np y orbitales perpendiculares al avión. Aunque estos dos pares son equivalentes en energía, el orbital np x en un átomo puede interactuar solo con el orbital np x en el otro, y el orbital np y en un átomo puede interactuar con solo el np y en el otro. Estas interacciones son de lado a lado en lugar de las interacciones de cabeza a cabeza características de los orbitales σ. Cada par de orbitales atómicos superpuestos vuelve a formar dos orbitales moleculares: uno corresponde a la suma aritmética de los dos orbitales atómicos y otro a la diferencia. La suma de estas interacciones de lado a lado aumenta la probabilidad de electrones en la región por encima y por debajo de una línea que conecta los núcleos, por lo que es un orbital molecular de unión que se llama orbital pi (π) (un orbital molecular de enlace formado a partir de las interacciones de lado a lado de dos o orbitales atómicos np más paralelos). La diferencia da como resultado el solapamiento de lóbulos orbitales con signos opuestos, lo que produce un plano nodal perpendicular al eje internuclear; de ahí que se trata de un orbital molecular antiunión, llamado orbital estrella pi (π*) Un orbital molecular antiunión formado a partir de la diferencia del lado a lado interacciones de dos o más orbitales atómicos np paralelos, creando un plano nodal perpendicular al eje internuclear. .
\[ \pi _{np_{x}}=np_{x}\left ( A \right )+np_{x}\left ( B \right ) \label{9.7.4} \]
\[ \pi ^{\star }_{np_{x}}=np_{x}\left ( A \right )-np_{x}\left ( B \right ) \label{9.7.5} \]
Los dos orbitales np y también se pueden combinar usando interacciones de lado a lado para producir un orbital\( \pi _{np_{y}} \) molecular de enlace y un orbital\( \pi _{np_{y}}^{\star } \) molecular antienlace. Debido a que los orbitales atómicos np x y np y interactúan de la misma manera (lado a lado) y tienen la misma energía, los orbitales\( \pi _{np_{x}} \) y\( \pi _{np_{y}} \) moleculares son un par degenerado, al igual que los\( \pi _{np_{x}}^{\star } \) y\( \pi _{np_{y}}^{\star } \) orbitales moleculares.
Energías para Moléculas Diatómicas Homonucleares
Ahora describimos ejemplos de sistemas que involucran moléculas diatómicas homonucleares del período 2, como N 2, O 2 y F 2. Cuando dibujamos un diagrama orbital molecular para una molécula, hay cuatro puntos clave para recordar:
- El número de orbitales moleculares producidos es el mismo que el número de orbitales atómicos utilizados para crearlos.
- A medida que aumenta el solapamiento entre dos orbitales atómicos, aumenta la diferencia de energía entre los orbitales moleculares enlazantes y antiligantes resultantes.
- Cuando dos orbitales atómicos se combinan para formar un par de orbitales moleculares, el orbital molecular de enlace se estabiliza tanto como el orbital molecular antienlace se desestabiliza.
- La interacción entre los orbitales atómicos es mayor cuando tienen la misma energía.
La Figura 9.7.4 es un diagrama de nivel de energía que se puede aplicar a dos átomos interactivos idénticos que tienen tres orbitales atómicos np cada uno. Hay seis orbitales p atómicos degenerados (tres de cada átomo) que se combinan para formar seis orbitales moleculares, tres enlaces y tres antienlaces. Los orbitales moleculares de unión son más bajos en energía que los orbitales atómicos debido a la mayor estabilidad asociada con la formación de un enlace. Por el contrario, los orbitales moleculares antiligantes son más altos en energía, como se muestra. La diferencia de energía entre los orbitales moleculares σ y σ* es significativamente mayor que la diferencia entre los dos conjuntos π y π*. La razón de esto es que el solapamiento orbital atómico y por lo tanto la fuerza de la interacción son mayores para un enlace σ que para un enlace π, lo que significa que el orbital molecular σ es más estable (menor en energía) que los orbitales moleculares π.
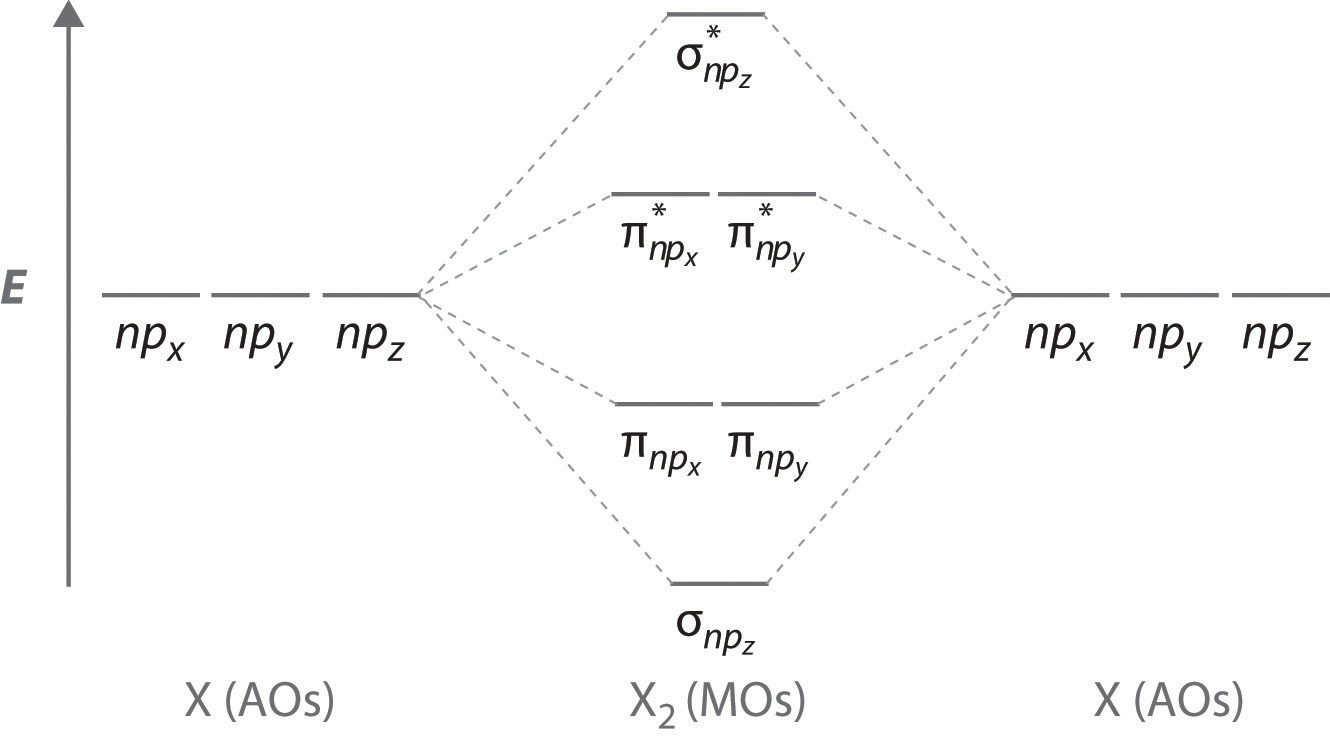
El número de orbitales moleculares siempre es igual al número total de orbitales atómicos con los que comenzamos.
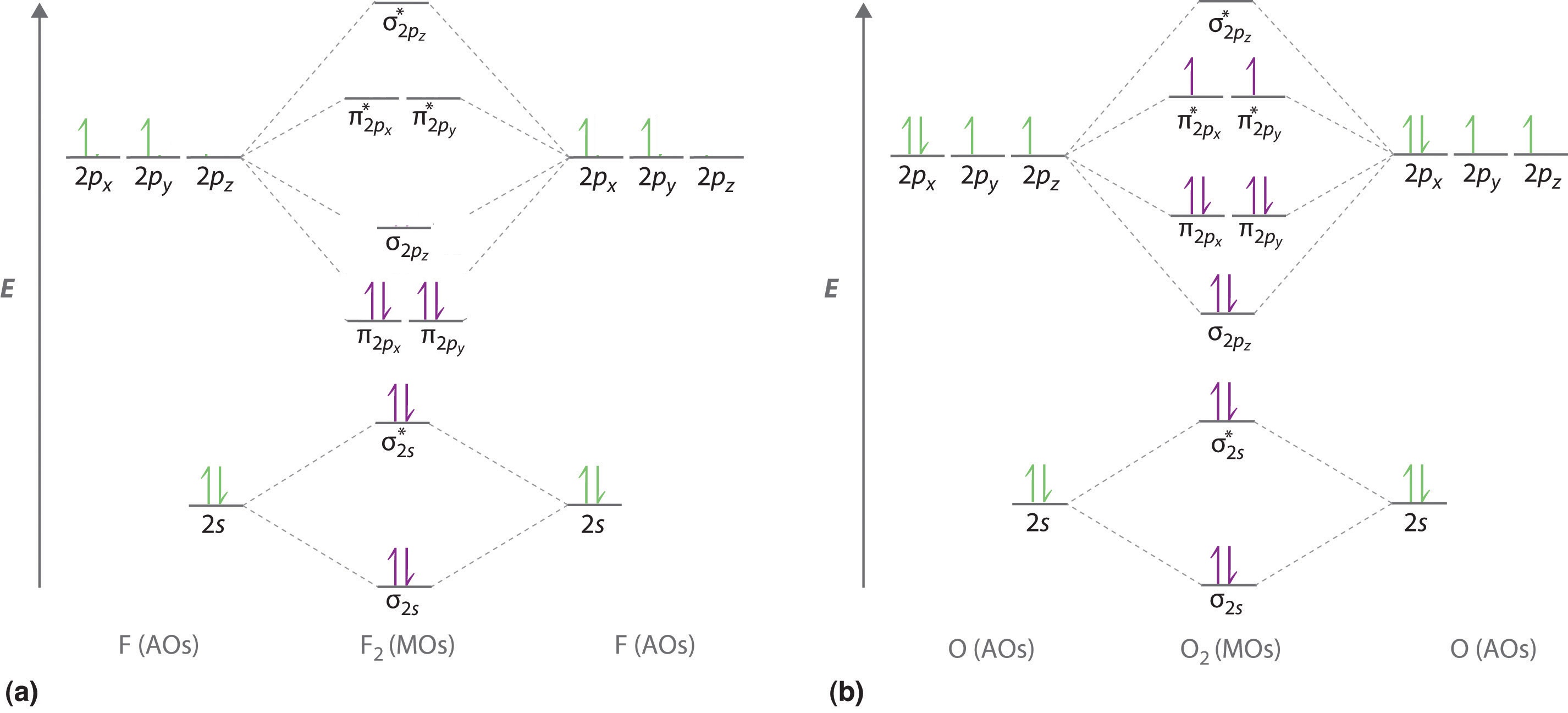
Ilustramos cómo usar estos puntos mediante la construcción de un diagrama orbital molecular de nivel de energía para F 2. Utilizamos el diagrama en la Figura\(\PageIndex{5a}\); los orbitales n = 1 (σ 1 s y σ 1 s *) se encuentran muy por debajo de los del nivel n = 2 y no se muestran. Como se ilustra en el diagrama, los orbitales moleculares σ 2 s y σ 2 s * son mucho más bajos en energía que los orbitales moleculares derivados de los orbitales atómicos de 2 p debido a la gran diferencia en energía entre los orbitales atómicos de 2 s y 2 p de flúor. El orbital molecular de menor energía derivado de los tres orbitales de 2 p en cada F es\( \sigma _{2p_{z}} \) y el siguiente más estable son los dos orbitales degenerados,\( \pi _{2p_{x}} \) y\( \pi _{2p_{y}} \). Para cada orbital de unión en el diagrama, hay un orbital antiadhesión, y el orbital antiadhesión se desestabiliza aproximadamente tanto como se estabiliza el orbital de unión correspondiente. Como resultado, el\( \sigma ^{\star }_{2p_{z}} \) orbital es mayor en energía que cualquiera de los degenerados\( \pi _{2p_{x}}^{\star } \) y\( \pi _{2p_{y}}^{\star } \) orbitales. Ahora podemos llenar los orbitales, comenzando por el que es más bajo en energía.
Cada flúor tiene 7 electrones de valencia, por lo que hay un total de 14 electrones de valencia en la molécula F 2. Comenzando en el nivel de energía más bajo, los electrones se colocan en los orbitales de acuerdo con el principio Pauli y las reglas de Hund. Dos electrones llenan cada uno los orbitales σ 2 s y σ 2 s *, 2 llenan el\( \sigma _{2p_{z}} \) orbital, 4 llenan los dos orbitales π degenerados y 4 llenan los dos orbitales π * degenerados, para un total de 14 electrones.
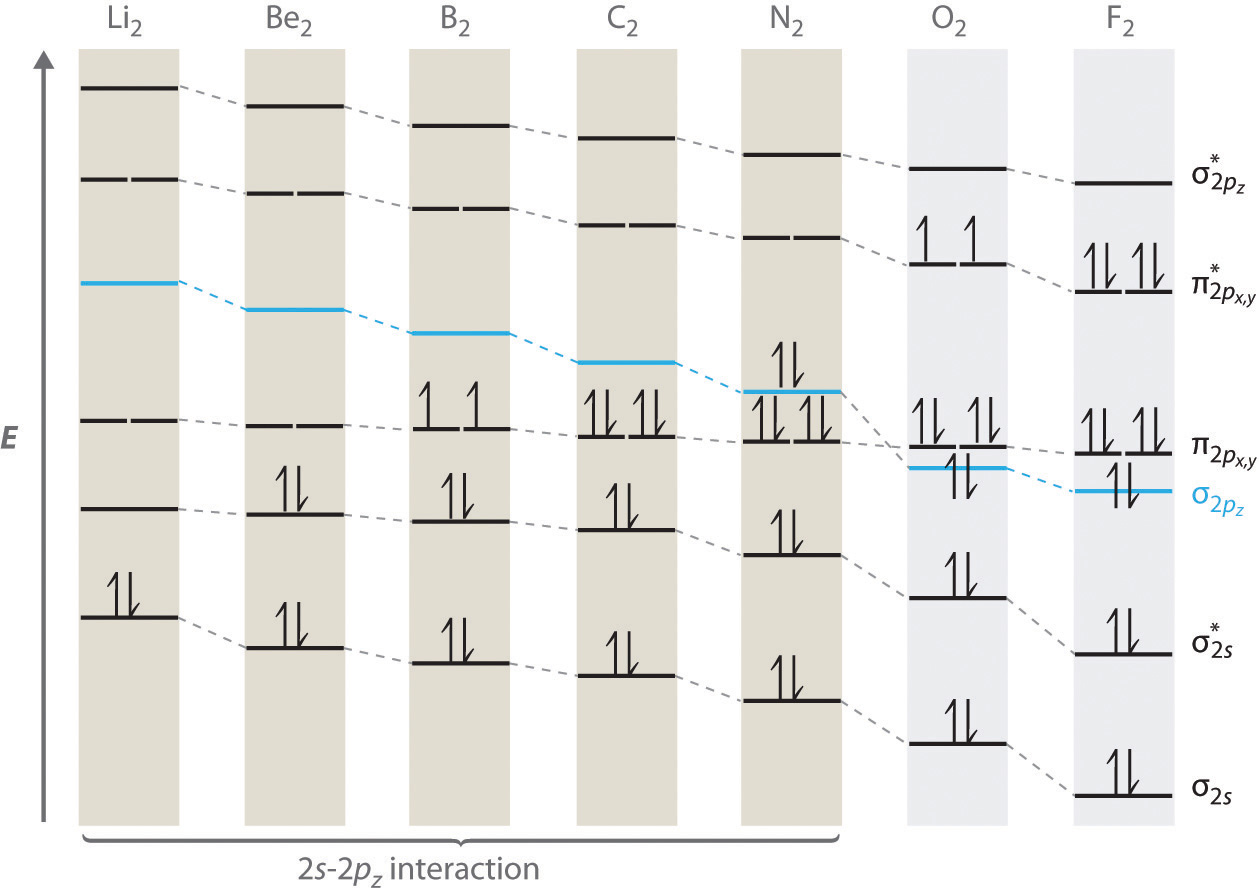
Para las moléculas diatómicas del periodo 2 a la izquierda de N 2 en la tabla periódica, se necesita un diagrama de nivel de energía orbital molecular ligeramente diferente debido a que el orbital\( \sigma _{2p_{z}} \) molecular es ligeramente mayor en energía que el degenerado\( \pi ^{\star }_{np_{x}} \) y\( \pi ^{\star }_{np_{y}} \) orbitales. La diferencia de energía entre los orbitales atómicos de 2 s y 2 p aumenta de Li 2 a F 2 debido al aumento de la carga nuclear y al pobre cribado de los electrones de 2 s por electrones en la subcapa de 2 p. La interacción de unión entre el orbital de 2 s en un átomo y el orbital 2 p z en el otro es más importante cuando los dos orbitales tienen energías similares. Esta interacción disminuye la energía del orbital σ 2 s y aumenta la energía de la\( \sigma _{2p_{z}} \) órbita. Así, para Li 2, Be 2, B 2, C 2 y N 2, el\( \sigma _{2p_{z}} \) orbital es mayor en energía que los\( \sigma _{3p_{z}} \) orbitales, como se muestra en la Figura 9.7.6 . Experimentalmente, la brecha de energía entre los orbitales atómicos ns y np aumenta a medida que aumenta la carga nuclear (Figura 9.7.6 ). Así, por ejemplo, el orbital\( \sigma _{2p_{z}} \) molecular está a una energía menor que el\( \pi _{2p_{x,y}} \) par.
Utilice un diagrama cualitativo de nivel de energía orbital molecular para predecir la configuración de los electrones, el orden de enlace y el número de electrones desapareados en S 2, un gas azul brillante a altas temperaturas.
Dado: especies químicas
Preguntado por: diagrama de nivel de energía orbital molecular, orden de enlace y número de electrones desapareados
Estrategia:
- Escribir la configuración electrónica de valencia del azufre y determinar el tipo de orbitales moleculares formados en S 2. Predecir las energías relativas de los orbitales moleculares en función de cuán cerca en energía están los orbitales atómicos de valencia entre sí.
- Dibujar el diagrama de nivel de energía orbital molecular para este sistema y determinar el número total de electrones de valencia en S 2.
- Llenar los orbitales moleculares en orden de aumentar la energía, asegurándose de obedecer el principio Pauli y la regla de Hund.
- Calcular el orden de unión y describir la unión.
Solución:
A Azufre tiene una configuración de electrones de valencia [Ne] 3 s 2 3 p 4. Para crear un diagrama de nivel de energía orbital molecular similar a los de las Figuras 9.7.6 y 9.7.7 , necesitamos saber qué tan cerca en energía están los orbitales atómicos de 3 s y 3 p porque su separación de energía determinará si el\( \pi _{3p_{x,y}} \) o el \( \sigma _{3p_{z}} \)> orbital molecular es mayor en energía. Debido a que la brecha de energía ns — np aumenta a medida que aumenta la carga nuclear, el orbital\( \sigma _{3p_{z}} \) molecular será menor en energía que el\( \pi _{3p_{x,y}} \) par.
B El diagrama de nivel de energía orbital molecular es el siguiente:
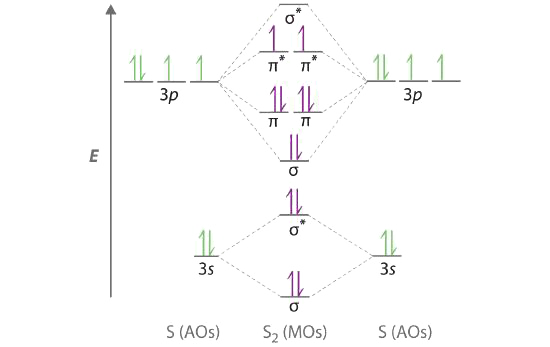
Cada átomo de azufre aporta 6 electrones de valencia, para un total de 12 electrones de valencia.
C Diez electrones de valencia se utilizan para llenar los orbitales a través\( \pi _{3p_{x}} \) y\( \pi _{3p_{y}} \), dejando 2 electrones para ocupar el degenerado\( \pi ^{\star }_{3p_{x}} \) y\( \pi ^{\star }_{3p_{y}} \) par. De la regla de Hund, los 2 electrones restantes deben ocupar estos orbitales por separado con sus espines alineados. Con los números de electrones escritos como superíndices, la configuración de electrones de S2 es\( \left ( \sigma _{3s} \right )^{2}\left ( \sigma ^{\star }_{3s} \right )^{2}\left ( \sigma _{3p_{z}} \right )^{2}\left ( \pi _{3p_{x,y}} \right )^{4}\left ( \pi _{3p ^{\star }_{x,y}} \right )^{2} \) con 2 electrones desapareados. El orden de enlace es (8 − 4) ÷ 2 = 2, por lo que predecimos un doble enlace S=S.
Utilice un diagrama cualitativo de nivel de energía orbital molecular para predecir la configuración de los electrones, el orden de enlace y el número de electrones desapareados en el ion peróxido (O 2 2−).
- Contestar
-
\( \left ( \sigma _{2s} \right )^{2}\left ( \sigma ^{\star }_{2s} \right )^{2}\left ( \sigma _{2p_{z}} \right )^{2}\left ( \pi _{2p_{x,y}} \right )^{4}\left ( \pi _{2p ^{\star }_{x,y}} \right )^{4} \)orden de enlace de 1; sin electrones desapareados
Orbitales moleculares formados a partir de ns con n p Orbitales
Aunque muchas combinaciones de orbitales atómicos forman orbitales moleculares, discutiremos solo otra interacción: un orbital atómico ns en un átomo con un orbital atómico np z en otro. Como se muestra en la Figura 9.7.7 , la suma de las dos funciones de onda atómica (ns + np z) produce un orbital molecular de enlace σ. Su diferencia (ns − np z) produce un orbital molecular σ* antienlace, que tiene un plano nodal de densidad de probabilidad cero perpendicular al eje internuclear.