9.8: La teoría molecular-orbital no predice una molécula de helio diatómica estable
- Page ID
- 79865
- Usando el orden de enlace como métrica para la existencia de moléculas
Orden de Bonos
En las estructuras de electrones de Lewis, el número de pares de electrones que mantienen dos átomos juntos se llamó el orden de enlace. Dentro del enfoque orbital molecular, el orden de enlace se define como la mitad del número neto de electrones de unión:
\[ \text{bond order}=\dfrac{\text{number of bonding electrons} - \text{number of antibonding electrons}}{2} \label{9.8.1} \]
Para calcular el orden de enlace de\(H_2\), sabemos que el orbital molecular\(σ_{1s}\) (enlace) contiene dos electrones, mientras que el orbital molecular\( \sigma _{1s}^{\star } \) (antienlace) está vacío. El orden de fianza de\(H_2\) es por lo tanto
\[ \text{bond order}=\dfrac{2-0}{2}=1 \label{9.8.2} \]
Este resultado corresponde al enlace covalente sencillo; los enlaces dobles y triples contienen cuatro o seis electrones, respectivamente, y corresponden a órdenes de enlace de 2 y 3.
Podemos usar diagramas de nivel de energía para describir la unión en otros pares de átomos e iones donde n = 1, como el ion H 2 +, el ion He 2 + y la molécula He 2. Nuevamente, primero llenamos los orbitales moleculares de menor energía mientras nos aseguramos de no violar el principio Pauli o las Reglas del Hund.

La figura\(\PageIndex{1a}\) muestra el diagrama de nivel de energía para el ion H 2 +, que contiene dos protones y solo un electrón. El electrón único ocupa el orbital molecular de\(σ_{1s}\) enlace, dando una configuración (σ 1 s) 1 electrón. El número de electrones en un orbital está indicado por un superíndice. En este caso, el orden de fianza es (vía Ecuación\ ref {9.8.1})
\[\text{bond order}=\dfrac{1-0}{2}=1/2 \nonumber \]
Debido a que el orden de enlace es mayor a cero, el ion H 2 + debería ser más estable que un átomo de H aislado y un protón. Por lo tanto, podemos usar un diagrama de nivel de energía orbital molecular y el orden de enlace calculado para predecir la estabilidad relativa de especies como H 2 +. Con un orden de enlace de solo 1/2 el enlace en H 2 + debería ser más débil que en la molécula H 2, y el enlace H-H debería ser más largo. Como se muestra en la Tabla 9.8.1 , estas predicciones concuerdan con los datos experimentales.
| Especies | Configuración de electrones | Orden de Bonos | Longitud del enlace (pm) | Energía de enlace (kJ/mol) |
|---|---|---|---|---|
| H 2 + | \((σ_{1s})^1\) | 1/2 | 106 | 269 |
| H 2 | \((σ_{1s})^2\) | 1 | 74 | 436 |
| Él 2 + | \( \left (\sigma _{1s} \right )^{2}\left (\sigma _{1s}^{\star } \right )^{1} \) | 1/2 | 108 | 251 |
| Él 2 | \( \left (\sigma _{1s} \right )^{2}\left (\sigma _{1s}^{\star } \right )^{2} \) | 0 | 5,500 | \(4.6 \times 10^{−5}\) |
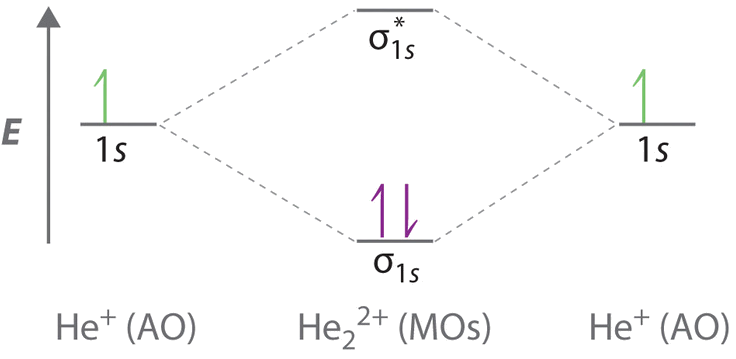
La figura\(\PageIndex{1b}\) es el diagrama de nivel de energía orbital molecular para\(\ce{He_2^{2+}}\). Este ion tiene un total de tres electrones de valencia. Debido a que los dos primeros electrones llenan completamente el orbital\(σ_{1s}\) molecular, el principio Pauli establece que el tercer electrón debe estar en el orbital\( \sigma _{1s}^{\star} \) antienlace, dando una configuración\( \left (\sigma _{1s} \right )^{2}\left (\sigma _{1s}^{\star } \right )^{1} \) electrónica. Esta configuración electrónica da un orden de enlace (a través de la Ecuación\ ref {9.8.1}) de
\[\text{bond order}=\dfrac{2-1}{2}=1/2 \nonumber \]
Al igual que con H 2 +, el ion He 2 + debería ser estable, pero el enlace He—He debe ser más débil y más largo que en H 2. De hecho, se puede preparar el ion He 2 +, y sus propiedades son consistentes con nuestras predicciones (Table 9.8.1 ).
Utilice diagramas orbitales moleculares de nivel de energía para predecir el orden de enlace y la estabilidad del\(\ce{He_2^{2+}}\) ion.
Dado: especies químicas
Preguntado por: diagrama de nivel de energía orbital molecular, orden de enlace y estabilidad
Estrategia:
- Combine los dos orbitales atómicos de valencia He para producir orbitales moleculares ligantes y antiadherentes. Dibujar el diagrama de nivel de energía orbital molecular para el sistema.
- Determinar el número total de electrones de valencia en el ion He 2 2 +. Llenar los orbitales moleculares en el diagrama de nivel de energía comenzando por el orbital con la energía más baja. Asegúrate de obedecer el principio Pauli y la regla de Hund mientras lo haces.
- Calcular el orden de enlace y predecir si la especie es estable.
Solución:
A Dos orbitales atómicos de He 1 s se combinan para dar dos orbitales moleculares: un orbital de\(σ_{1s}\) enlace a menor energía que los orbitales atómicos y un orbital\( \sigma _{1s}^{\star } \) antienlace a mayor energía. El enlace en cualquier molécula diatómica con dos átomos de He puede describirse usando el siguiente diagrama orbital molecular:
B El ion He 2 2 + tiene sólo dos electrones de valencia (dos de cada átomo He menos dos para la carga +2). También podemos ver a He 2 2+ como formado a partir de dos iones He +, cada uno de los cuales tiene un solo electrón de valencia en el orbital atómico de 1 s. Ahora podemos llenar el diagrama orbital molecular:
Los dos electrones ocupan el orbital molecular de menor energía, que es el orbital de enlace (\(σ_{1s}\)), dando una configuración (σ 1 s) de 2 electrones. Para evitar violar el principio Pauli, los espines electrónicos deben estar emparejados.
C Entonces el orden de los bonos es (vía Ecuación\ ref {9.8.1})
\[ \dfrac{2-0}{2} =1 \nonumber \]
Por lo tanto, se predice que él 2 + contendrá un solo vínculo He—He. Por lo tanto, debe ser una especie estable.
Utilice un diagrama de nivel de energía orbital molecular para predecir la configuración valencia-electrón y el orden de enlace del\(\ce{H_2^{2−}}\) ion. ¿Es esta una especie estable?
- Contestar
-
\(\ce{H_2^{2−}}\)tiene una configuración de electrones de valencia\( \left (\sigma _{1s} \right )^{2}\left (\sigma _{1s}^{\star } \right )^{2} \) con un orden de enlace de 0. Por lo tanto, se predice que sea inestable.
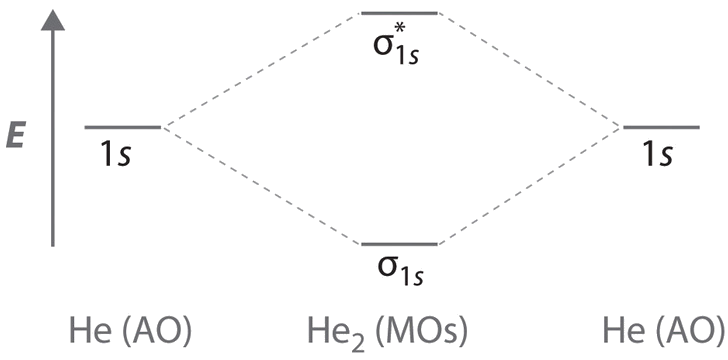
El dímero de helio
Finalmente, examinamos la molécula He 2, formada a partir de dos átomos de He con configuraciones de 1 s 2 electrones. La figura\(\PageIndex{1c}\) es el diagrama de nivel de energía orbital molecular para He 2. Con un total de cuatro electrones de valencia, tanto los orbitales\( \sigma _{1s} \) ligantes como los\( \sigma _{1s}^{\star } \) antiadherentes deben contener dos electrones. Esto da una configuración\( \left (\sigma _{1s} \right )^{2}\left (\sigma _{1s}^{\star } \right )^{1} \) electrónica, con un orden de enlace predicho (a través de la Ecuación\ ref {9.8.1}) de
\[\text{bond order}= \dfrac{2 − 2}{2} = 0 \label{heliumdimer} \]
lo que indica que la\(He_2\) molécula no tiene enlace covalente neto y no es una especie estable.
La capacidad de rastrear el orden de enlace a la fuerza de unión se debe al hecho de que la diferencia de energía entre el orbital\( \sigma _{1s}^{\star } \) molecular antienlace y el orbital\(1s\) atómico original es mayor que la diferencia de energía entre el orbital molecular de unión y el orbital\( \sigma _{1s} \) molecular de unión\(1s\) orbitales atómicos. Esto se derivó previamente donde la energía de estabilización (\(\Delta E_{+}\)) del orbital\( \sigma _{1s} \) molecular es menor que la energía de desestabilización (\(\Delta E_{-}\)) del orbital\( \sigma _{1s}^{\star } \) molecular antienlace:
\[ \begin{align} \Delta E_{\pm} &= E_{\pm} - E_H \\[4pt] &= \dfrac {e^2}{4\pi \epsilon _0 R} + \dfrac {J \pm K}{1 \pm S} \label {10.31} \end{align} \]
De ahí que el orbital\( \sigma _{1s}^{\star }\) molecular antienlace esté más desestabilizado en relación con los orbitales atómicos que el orbital\( \sigma _{1s} \) molecular de unión se estabiliza en relación con los orbitales\(1s\) atómicos (\(E_H\).
El hecho de que la diferencia de energía MO antienlace sea mayor que la diferencia de energía orbital\( \sigma _{1s} \) molecular de enlace es la verdadera razón por la que no se predice que el dímero de helio exista con un enlace covalente. De los cuatro electrones de valencia en el dímero de helio, dos llenarán el orbital\( \sigma _{1s}\) molecular de unión, y los otros dos llenarán el orbital\( \sigma _{1s}^{\star }\) molecular antienlace. Los dos electrones en el orbital\( \sigma _{1s} \) molecular de unión lograrán cierta estabilización en relación con los orbitales\(1s\) atómicos, pero los dos electrones en el orbital\( \sigma _{1s}^{\star } \) molecular antienlace lograrán una mayor desestabilización en relación con su posición en los orbitales atómicos. El resultado neto es una molécula menos estable que si los electrones permanecieran en sus respectivos orbitales\(1s\) atómicos.
Los electrones en los orbitales antiadherentes cancelan (y exceden) la estabilización resultante de los electrones en orbitales de enlace. En consecuencia, cualquier sistema que tenga igual número de electrones enlazantes y antiadherentes tendrá un orden de enlace de 0, y se predice que sea inestable y por lo tanto no exista en la naturaleza (al menos como un complejo de enlace covalente).
Con base en la teoría orbital molecular discutida anteriormente, la\(\ce{He_2}\) molécula no debería existir ya que no se formó ningún enlace covalente entre los átomos de helio (Ecuación\ ref {heliumdímero}). Sin embargo, la descripción orbital molecular anterior descuida la fuerza de van der Waals que existe entre los átomos como lo demuestra la existencia de helio líquido (a 4 K). Entonces, una “molécula” compuesta por dos átomos de helio unidos por la fuerza de van der Waals puede existir por esta fuerza atractiva en su lugar, y lo hace.
Una molécula de dímero de helio unida por las fuerzas de Van der Waals fue propuesta por primera vez por John Clarke Slater en 1928 y observada en 1993 por Gentry y compañeros de trabajo. Curiosamente,\(\ce{He_2}\) es la molécula más grande conocida de dos átomos cuando se encuentra en su estado fundamental con una longitud de enlace extremadamente larga con una separación de aproximadamente 5,200pm. La energía de unión es solo\(4.6 \times 10^{−5}\, kJ/mol\), por lo que el\(\ce{He-He}\) enlace es 5,000 veces más débil que el enlace covalente en la molécula de hidrógeno (Tabla 9.8.1 ).
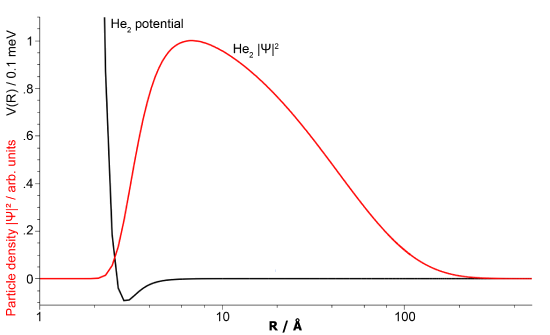
Conclusión
La disminución de energía causada por el orbital de unión (interferencia constructiva de los orbitales atómicos) se cancela por el aumento de energía causado por el orbital antienlace (interferencia destructiva de los orbitales atómicos), por lo que no es energéticamente favorable que los átomos de helio estén en tal proximidad, por lo que si surge esa situación, se separarán rápidamente ya que no hay fuerza que los mantenga ahí.

