13.1: El espectro electromagnético
- Page ID
- 79880
Un aspecto importante del estudio de Química Física es poder reconocer la interacción de las moléculas con el entorno. La espectroscopia molecular proporciona una imagen clara de cómo interactúan las moléculas diatómicas y poliatómicas al observar la frecuencia, la longitud de onda, el número de onda, la energía y el proceso molecular. También podremos ver las propiedades de absorción de moléculas en diversas regiones del espectro electromagnético.
Radiación electromagnética
La radiación electromagnética, la luz, es una forma de energía cuyo comportamiento se describe por las propiedades tanto de las ondas como de las partículas. Algunas propiedades de la radiación electromagnética, como su refracción cuando pasa de un medio a otro, se explican mejor al describir la luz como una onda. Otras propiedades, como la absorción y emisión, se describen mejor al tratar la luz como una partícula. La naturaleza exacta de la radiación electromagnética sigue sin estar clara, como lo ha hecho desde el desarrollo de la mecánica cuántica en el primer cuarto del siglo XX. Sin embargo, los modelos duales de comportamiento de onda y partícula proporcionan una descripción útil para la radiación electromagnética.
La radiación electromagnética consiste en campos eléctricos y magnéticos oscilantes que se propagan a través del espacio a lo largo de una trayectoria lineal y con una velocidad constante. En un vacío la radiación electromagnética viaja a la velocidad de la luz,\(c\), que es\(2.997 92 \times 10^8\, m/s}\). Cuando la radiación electromagnética se mueve a través de un medio que no sea un vacío su velocidad\(v\),, es menor que la velocidad de la luz en un vacío. La diferencia entre\(v\) y\(c\) es suficientemente pequeña (< 0.1%) para que la velocidad de la luz a tres cifras significativas,\(3.00 \times 10^8\, m/s\), sea lo suficientemente precisa para la mayoría de los propósitos.
Las oscilaciones en los campos eléctrico y magnético son perpendiculares entre sí, y a la dirección de propagación de la onda. La Figura 13.1.1 muestra un ejemplo de radiación electromagnética polarizada en el plano, que consiste en un solo campo eléctrico oscilante y un solo campo magnético oscilante.
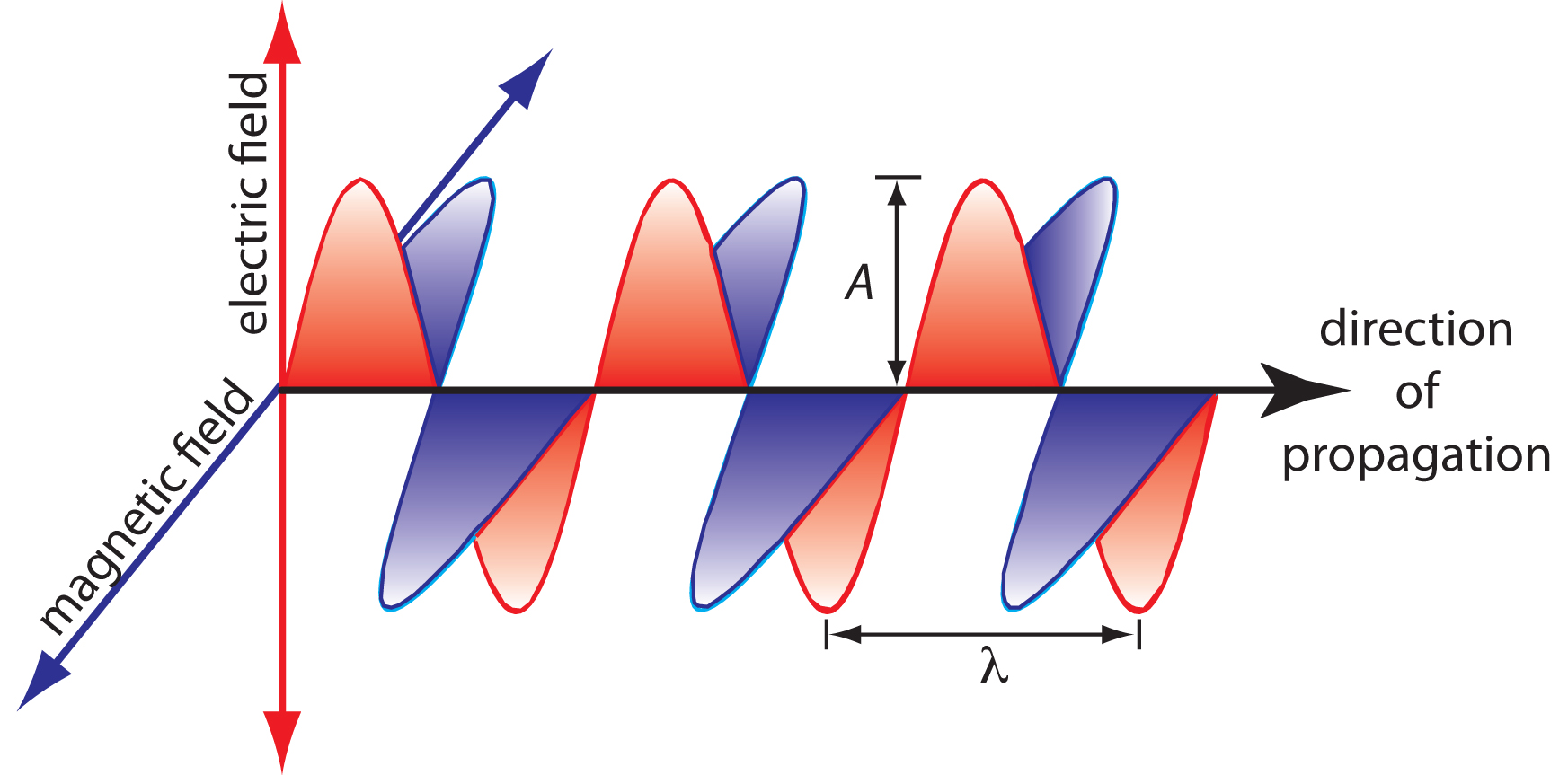
Una onda electromagnética se caracteriza por varias propiedades fundamentales, incluyendo su velocidad, amplitud, frecuencia, ángulo de fase, polarización y dirección de propagación. 2 Por ejemplo, la amplitud del campo eléctrico oscilante en cualquier punto a lo largo de la onda de propagación es
\[A_\ce{t} = A_\ce{e}\sin(2πνt + \phi) \nonumber \]
donde\(A_t\) está la magnitud del campo eléctrico en el tiempo\(t\),\(A_e\) es la amplitud máxima del campo eléctrico,\(\nu\) es la frecuencia de la onda —el número de oscilaciones en el campo eléctrico por unidad de tiempo— y\(\phi\) es un ángulo de fase, que da cuenta del hecho de que no es\(A_t\) necesario tener un valor de cero a\(t = 0\). La ecuación idéntica para el campo magnético es
\[A_\ce{t} =A_\ce{m}\sin(2πνt + \phi) \nonumber \]
donde\(A_m\) está la amplitud máxima del campo magnético.
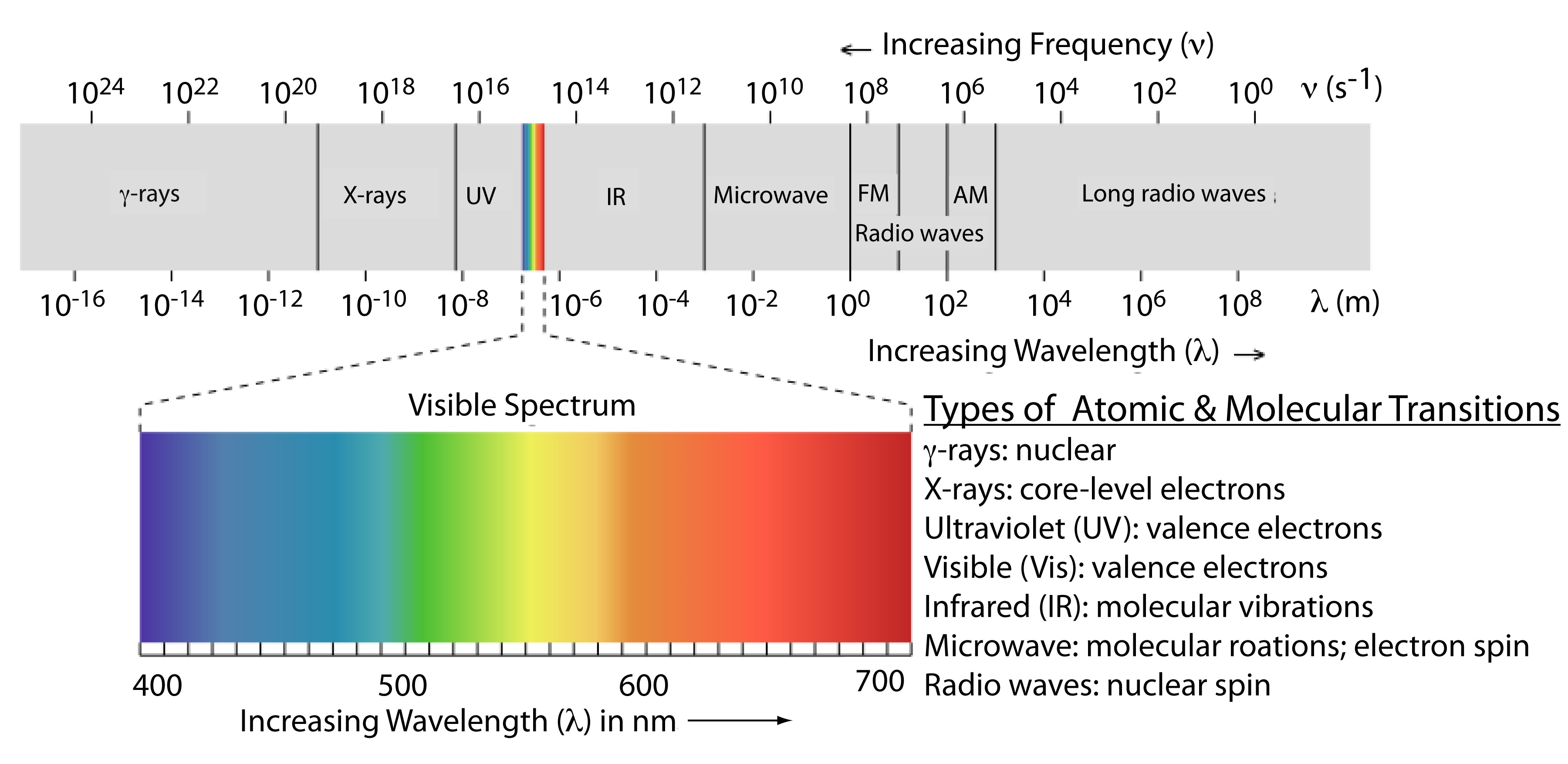
La frecuencia y la longitud de onda de la radiación electromagnética varían en muchos órdenes de magnitud. Por conveniencia, dividimos la radiación electromagnética en diferentes regiones, el espectro electromagnético, en función del tipo de transición atómica o molecular que da lugar a la absorción o emisión de fotones (Figura 13.1.2 ). Los límites entre las regiones del espectro electromagnético no son rígidos, y es posible la superposición entre regiones espectrales.
Otras Unidades
Otras propiedades también son útiles para caracterizar el comportamiento de onda de la radiación electromagnética. La longitud de onda, λ, se define como la distancia entre máximos sucesivos (Figura 13.1.1 ). Para la radiación electromagnética ultravioleta y visible la longitud de onda generalmente se expresa en nanómetros (1 nm = 10 —9 m), y para la radiación infrarroja se da en micras (1 μm = 10 —6 m). La relación entre longitud de onda y frecuencia es
\[λ = \dfrac{c}{ν} \nonumber \]
Otra unidad útil de la unidad es el número de onda\(\tilde{ν}\), que es el recíproco de la longitud de onda
\[\tilde{ν} = \dfrac{1}{λ} \nonumber \]
Los números de onda se utilizan frecuentemente para caracterizar la radiación infrarroja, con las unidades dadas en cm —1.
En 1817, Josef Fraunhofer estudió el espectro de la radiación solar, observando un espectro continuo con numerosas líneas oscuras. Fraunhofer etiquetó con letras la más prominente de las líneas oscuras. En 1859, Gustav Kirchhoff demostró que la línea D en el espectro del sol se debía a la absorción de la radiación solar por los átomos de sodio. La longitud de onda de la línea D de sodio es 589 nm. ¿Cuáles son la frecuencia y el número de onda para esta línea?
Solución
La frecuencia y el número de onda de la línea D de sodio son
\[ν = \dfrac{c}{λ} = \mathrm{\dfrac{3.00×10^8\: m/s}{589×10^{−9}\: m} = 5.09×10^{14}\: s^{−1}} \nonumber \]
\[\tilde{ν} = \dfrac{1}{λ} = \mathrm{\dfrac{1}{589×10^{−9}\: m} × \dfrac{1\: m}{100\: cm} = 1.70×10^4\: cm^{−1}} \nonumber \]
Otra serie históricamente importante de líneas espectrales es la serie Balmer de líneas de emisión que forman hidrógeno. Una de las líneas tiene una longitud de onda de 656.3 nm. ¿Cuáles son la frecuencia y el número de onda para esta línea?
Arriba, definimos varias propiedades características de la radiación electromagnética, incluyendo su energía, velocidad, amplitud, frecuencia, ángulo de fase, polarización y dirección de propagación. Una medición espectroscópica solo es posible si la interacción del fotón con la muestra conduce a un cambio en una o más de estas propiedades características. Podemos dividir la espectroscopia en dos amplias clases de técnicas. En una clase de técnicas hay una transferencia de energía entre el fotón y la muestra. Table 13.1.1 proporciona una lista de varios ejemplos representativos.
| Tipo de Transferencia de Energía | Región del Espectro Electromagnético | Técnica espectroscópica |
|---|---|---|
| absorción | γ -Rayo | Espectroscopia Mossbauer |
| Rayos X | Espectroscopia de absorción de rayos X | |
| UV/Vis |
Espectroscopia UV/Vis espectroscopía de absorción atómica |
|
| IR |
espectroscopía infrarroja espectroscopía raman |
|
| Microondas | espectroscopía de microondas | |
| Onda de radio |
espectroscopía de resonancia de espín electrónico espectroscopía de resonancia magnética nuclear |
|
| emisión (excitación térmica) | UV/Vis | espectroscopía de emisión atómica |
| fotoluminiscencia | Rayos X | Fluorescencia de rayos |
| UV/Vis |
espectroscopía de fluorescencia espectroscopía de fosforescencia espectroscopía de fluorescencia atómica |
|
| quimioluminiscencia | UV/Vis | espectroscopia de quimioluminiscencia |
El espectro electromagnético proporciona información clara de las moléculas si son transiciones rotacionales, transiciones vibracionales o transiciones electrónicas. Una molécula o un conjunto de moléculas pueden ser leídas por la absorción de radiación de microondas que proporciona transiciones entre los niveles de energía rotacional. Además, si las moléculas absorben la radiación infrarroja proporciona las transiciones entre los niveles vibracionales, sigue por las transiciones entre los niveles de energía rotacional. Finalmente, cuando las moléculas absorben radiación visible y ultravioleta da transiciones entre los niveles de energía electrónica, sigue por transiciones simultáneas entre los niveles vibracionales y rotacionales.
Cuando se le da el nivel de energía de las moléculas junto con la longitud de onda, podemos calcular fácilmente la frecuencia de las moléculas donde caen en las regiones del espectro electromagnético:
\[\Delta E=E_u-E_l=h \nu \nonumber \]
La ecuación anterior describe el cambio de energía entre el estado superior y el estado inferior de la energía.
- La frecuencia cae entre 10 9 - 10 11 que está en el rango de microondas se correlaciona con la rotación de moléculas poliatómicas.
- La frecuencia cae entre 10 11 - 10 13 que se encuentra en el rango del infrarrojo lejano se correlaciona con la rotación de moléculas pequeñas.
- La frecuencia cae entre 10 13 - 10 14 que está en el rango infrarrojo se correlaciona con las vibraciones de los enlaces flexibles.
- La frecuencia cae entre 10 14 - 10 16 que está en el rango visible y ultravioleta se correlaciona con las transiciones electrónicas.
La poderosa técnica de averiguar la frecuencia de las moléculas puede ayudarnos a determinar la longitud del enlace, la temperatura, la distribución de probabilidad como aprenderás más adelante del grado de libertades y cómo se somete el proceso en una reacción específica.

