16.4: La Ley de los Estados Correspondientes
- Page ID
- 80020
van der Waals asumió que todos los gases reales en los estados correspondientes deberían comportarse de manera similar. El estado correspondiente que eligió usar van der Waals se denomina estado reducido, el cual se basa en la desviación de las condiciones de una sustancia de sus propias condiciones críticas. Podemos definir cantidades reducidas:
\[P_r = \dfrac{P}{P_c} \nonumber \]
\[V_r= \dfrac{V}{V_c} \nonumber \]
\[T_r= \dfrac{T}{T_c} \nonumber \]
Por sustitución en la ecuación de van der Waals encontramos:
\[ \left( P_r + \dfrac{3}{\bar{V}_r^2} \right) \left( \bar{V}_r - \dfrac{1}{3} \right) = \dfrac{8}{3} T_r \label{vdw} \]
Lo que significa que los parámetros críticos para un gas se pueden expresar en términos de\(a\) y\(b\) parámetros:
\[V_c=3b \nonumber \]
\[P_c=\dfrac{a}{27b^2} \nonumber \]
y:
\[T_c=\dfrac{8a}{27b R} \nonumber \]
La formación de la ecuación de estado de van de Waal en términos de los parámetros críticos en la Ecuación\(\ref{vdw}\) es una ecuación universal para todos los gases. Aunque las presiones y volúmenes reales pueden diferir, se dice que dos gases están en los estados correspondientes si su presión, volumen y temperatura reducidos son los mismos. Lo que dice es que el comportamiento de todos los gases (¡y líquidos!!) es más o menos lo mismo, excepto por un factor de escala que está relacionado con el punto crítico de la sustancia. El valor de compresibilidad (\(Z\)) de 3/8 en el punto crítico para la ecuación de van der Waals no está realmente de acuerdo con la medición. Es por ello que las expresiones más complicadas de Redlich-Kwong y Peng-Robertson son mejores, aunque la idea es la misma. De ahí que todo lo que uno necesita saber para describir el comportamiento de cualquier fluido es su punto crítico. Por ejemplo, el argón se comporta de manera muy similar a 300 K que el etano a 600 K porque estas temperaturas corresponden al doble de sus respectivas temperaturas críticas (150.72 K y 305.4 K, respectivamente) así\(T_r=2.0\).
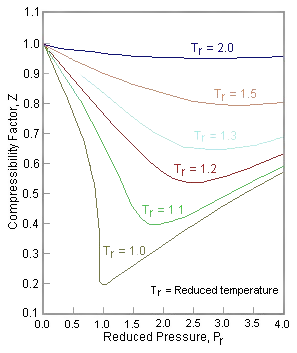
Podemos reescribir la expresión universal para compresibilidad\(Z\) usando variables reducidas y graficar valores medidos\(Z\) frente a la presión reducida,\(P_r\) (ver Figura 16.4.1 ). Como puede ver, se pueden hacer coincidir gases/líquidos muy diferentes como el nitrógeno y el agua si sus propiedades se trazan en relación con los puntos críticos en lugar de en términos absolutos. El factor de compresibilidad\(Z\) can also be cast into the form of corresponding states showing that \(Z\) also can be expressed as a universal function of \(V_r\) and \(T_r\) or any other two reduced quantities:
\[Z=\dfrac{\bar{V}_r}{\bar{V}_r–\dfrac{1}{3}} – \dfrac{9}{8\bar{V}_r T_r} \nonumber \]
Van der Waals no se detuvo aquí. Continuó describiendo la causa raíz de la condensación de gases en líquidos a temperaturas más bajas: las interacciones atractivas entre las moléculas.

