19.3: Trabajo y Calor no son Funciones de Estado
- Page ID
- 79375
El calor y el trabajo son funciones de trayectoria
Heat (\(q\)) y work (\(w\)) son funciones de ruta, no funciones de estado:
- Son dependientes del camino.
- Son transferencia de energía → no son intrínsecos al sistema.
Las funciones que dependen de la ruta tomada, como work (\(w\)) y heat (\(q\)), se denominan funciones de ruta.
Reversible versus irreversible
Consideremos un pistón que está siendo comprimido a temperatura constante (isotérmica) a la mitad de su volumen inicial:
- Comienza con cilindro de 1 litro, tanto de presión externa como interna de 1 bar.
- Pegue el pistón en una posición fija.
- Poner el cilindro en una cámara de presión con\(P_{ext}=2\) barra.
- De repente tira de la clavija.
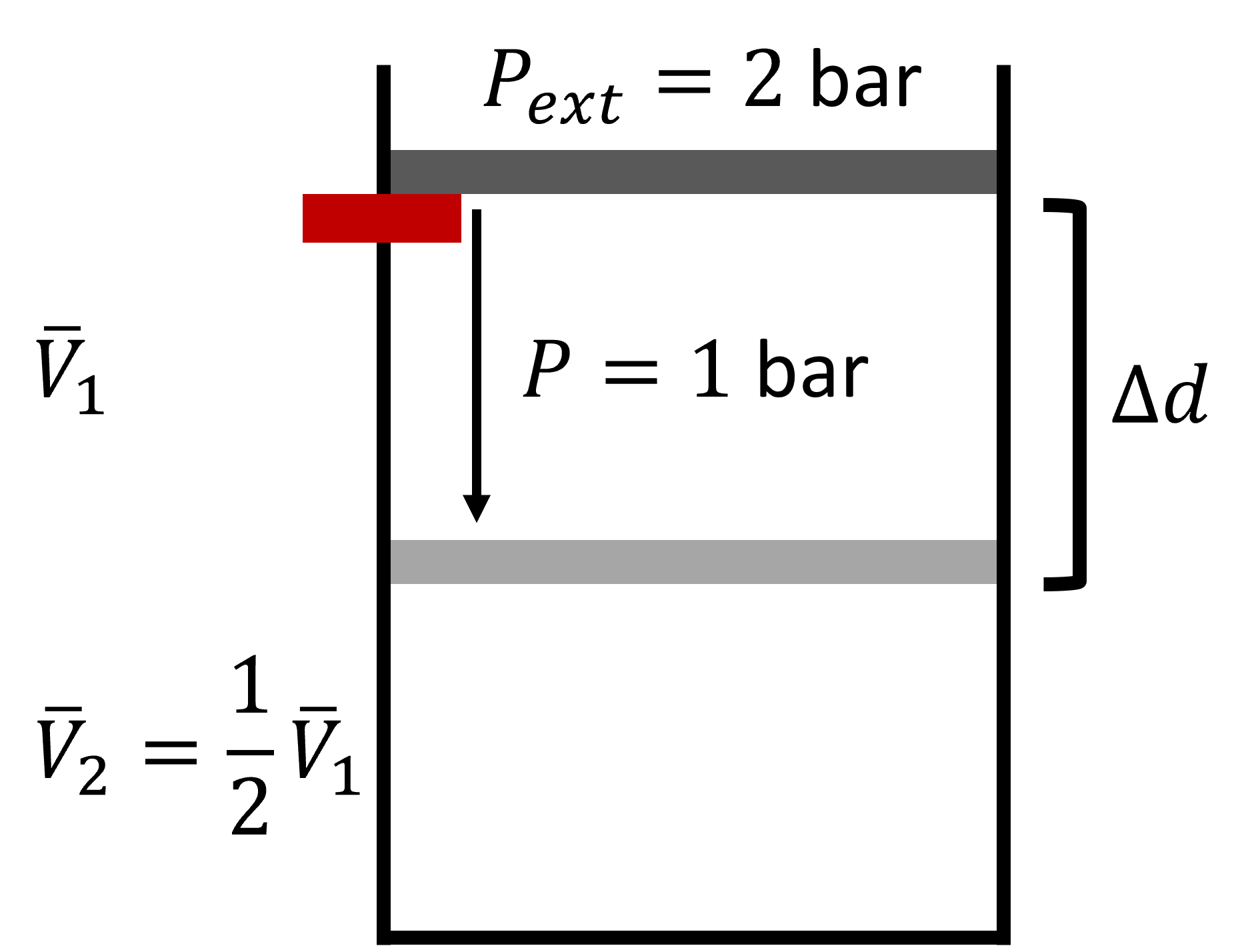
El pistón se disparará hasta que las presiones interna y externa se equilibren nuevamente y el volumen sea de 1/2 L. Observe que la presión externa se mantuvo constante a 2 bar durante la tracción de clavija y que las presiones interna y externa no fueron equilibrado en todo momento. En un\(P-V\) diagrama de un gas ideal,\(P\) se encuentra una función hiperbólica de\(V\) bajo temperatura constante (isotérmica), pero esto se refiere a la presión interna del gas. Es la externa la que cuenta a la hora de trabajar computacional y no son necesariamente las mismas. Siempre y cuando\(P_{external}\) sea constante, el trabajo está representado por un rectángulo.
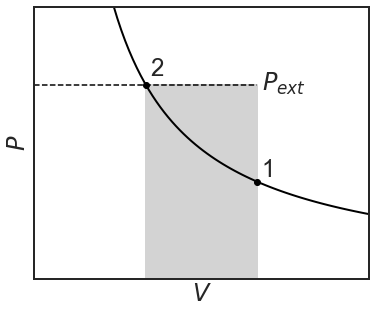
La cantidad de trabajo que se realiza es igual a la región sombreada y en ecuación:
\[w=-\int^{V_2}_{V_1}{PdV}=-P_{ext}(V_2-V_1)=-P\Delta V \nonumber \]
Esto representa la cantidad máxima de trabajo que se puede realizar para una compresión isotérmica. Se está trabajando en el sistema, por lo que el trabajo general que se está realizando es positivo. Repetimos el experimento, pero esta vez el pistón se comprimirá reversiblemente sobre pasos infinitesimalmente pequeños donde\(P_{ext}=P_{system}\):
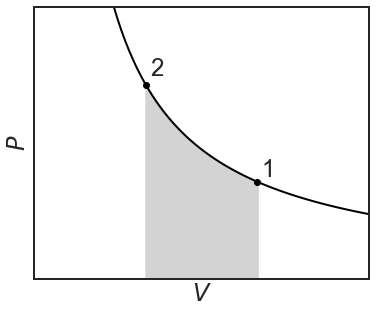
Para un gas ideal, la cantidad de trabajo que se realiza a lo largo de la compresión reversible es:
\[w=-\int^{V_2}_{V_1}{PdV}=-nRT\int^{V_2}_{V_1}{\frac{1}{V}}=-nRT\ln{\left(\frac{V_2}{V_1}\right)} \nonumber \]
La cantidad de trabajo que se está realizando a los dos sistemas no es la misma en los dos diagramas (ver las áreas grises). El trabajo no es un estado, sino una función path, ya que depende del camino tomado. Se puede decir, cuál es la gran diferencia. En ambos casos, el sistema se comprime del estado 1 al estado 2. La clave es la palabra de repente. Al fijar la posición en su lugar para la primera compresión, hemos creado una situación en la que la presión externa es mayor que la presión interna (\(P_{ext}>P\)). Debido a que el trabajo se realiza repentinamente al sacar la clavija, la presión interna está luchando por alcanzar la externa. Durante la segunda compresión, tenemos\(P_{ext}=P\) en todo momento. Es un poco como caerse de un acantilado versus deslizarse suavemente por una colina. El camino uno se llama camino irreversible, el segundo camino reversible.
Un camino reversible es un camino que sigue una serie de estados en reposo (es decir, se permite que las fuerzas se equilibren en todo momento). En una irreversible las fuerzas sólo se equilibran al final del proceso.
Observe que se está trabajando menos en la compresión isotérmica reversible que en la compresión isotérmica irreversible de un solo paso. De hecho, la cantidad mínima de trabajo que se puede realizar durante una compresión siempre ocurre a lo largo de la trayectoria reversible.
Expansión isotérmica
Consideremos un pistón que se está expandiendo a temperatura constante (isotérmica) al doble de su volumen inicial:
- Comienza con cilindro de 1 litro en una cámara de presión con una presión tanto externa como interna de 2 bar.
- Pegue el pistón en una posición fija.
- Saque el cilindro de la cámara de presión con P ext = 1 bar.
- De repente tira de la clavija.

El pistón se disparará hasta que las presiones interna y externa se equilibren nuevamente y el volumen sea de 2 L. Observe que la presión externa se mantuvo constante a 1 bar durante la tracción de clavija y que las presiones interna y externa no fueron equilibrado en todo momento.
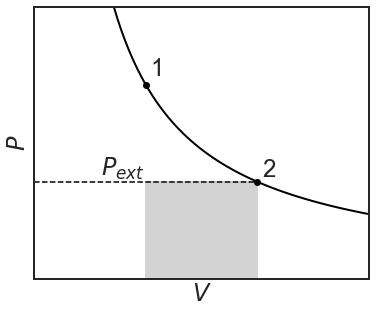
La cantidad de trabajo irreversible que se realiza vuelve a ser igual a la región sombreada y a la ecuación:
\[w=-P\Delta V=-P_{ext}(V_2-V_1)=-P\Delta V \nonumber \]
Esto representa la cantidad mínima de trabajo que se puede realizar para una expansión isotérmica. Se está trabajando en el sistema, por lo que el trabajo general que se está realizando es negativo. Repetimos el experimento, pero esta vez el pistón se comprimirá reversiblemente sobre pasos infinitesimalmente pequeños donde\(P_{ext}=P_{system}\):
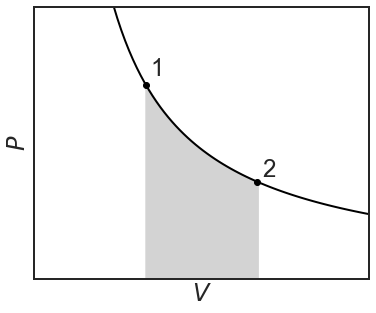
Observe que no sólo se está haciendo más trabajo que la expansión isotérmica irreversible de un solo paso, sino que es la misma cantidad de trabajo que se está realizando que la compresión isotérmica reversible. Esta es la cantidad máxima de trabajo que se puede realizar durante una expansión.

