19.5: Un proceso adiabático es un proceso en el que no se transfiere energía como calor
- Page ID
- 79388
Expansión isotérmica de un gas ideal
Para un gas ideal monatómico hemos visto que la energía\(\langle E \rangle\) observada como\(U= 3/2 nRT\). Esto significa que la energía solo depende de la temperatura y si un gas se comprime isotérmicamente, entonces la energía interna no cambia:
\[ΔU_{isothermal-ideal gas} = 0 \nonumber \]
Esto significa que el trabajo reversible debe cancelar el calor reversible:
\[ΔU_{rev} = w_{rev} + q_{rev} = 0 \nonumber \]
Por lo tanto
\[w_{rev} = - q_{rev} \nonumber \]
así a partir de la expresión del trabajo reversible para expansión en la última sección
\[ q_{rev}= nRT\ln \dfrac{V_2}{V_1} \nonumber \]
Si\(V_2>V_1\) (expansión), entonces usted (o el ambiente) debe poner calor en el sistema porque este es un número positivo.
Expansión adiabática de un gas ideal
Ahora suponga que se asegura de que no pueda entrar calor al cilindro. (Ponlo en espuma de poliestireno o algo así). Entonces el camino aún puede ser reversible (tracción lenta) pero el proceso es entonces adiabático.
Este bat- parte proviene de un verbo griego βαινω (baino) que significa caminar, comparar acro bat, alguien que va a lugares altos (acro-). La parte δια (dia) significa 'a través' (cf. diagrama, diorama, diagonal etc.) y el prefijo α- (a-) lo niega todo (comparar atípico versus típico).
Por lo que la espuma de poliestireno evita que el calor pase por la pared. Al expandir el gas de V 1 a V 2 todavía funciona reversible pero ¿de dónde viene eso? Sólo puede provenir de la propia energía interna. Entonces en este caso cualquier cambio energético debe consistir en trabajo (medios adiabáticos:\(δq=0\)).
\[dU = δw_{rev} \nonumber \]
Esto implica que la temperatura debe bajar, porque si\(U\) cambia, entonces\(T\) debe cambiar.
El cambio de energía con la temperatura a volumen constante se conoce como la capacidad calorífica (a volumen constante)\(C_v\)
\[ C_v =\left( \dfrac{\partial U}{\partial T} \right)_V \nonumber \]
Para un gas ideal\(U\) solo cambia con la temperatura, de modo que
o:
Ahora podemos comparar dos rutas para ir de estado\(P_1,V_1,T_1\) a estado\(P_2,V_2,T_1\):
- Expansión isotérmica reversible A
- Expansión adiabática reversible B seguida de calentamiento isocórico reversible C
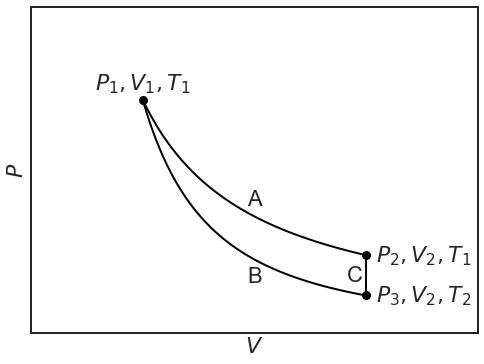
Observe que la temperatura permanece\(T_1\) para la trayectoria A (¡isoterma!) , pero que cae\(T_2\) sobre el adiabat B, de manera que el cilindro tiene que calentarse isocóricamente, C, para recuperar la misma temperatura.
\(\Delta U_{tot}\)debe ser lo mismo tanto para la ruta A como para la ruta combinada B+C, porque los puntos finales son los mismos (¡\(U\)es una función de estado!). Como los puntos y están a la misma temperatura y\(U\) solo depende de\(T\):
\[\Delta U_{tot}=0 \nonumber \]
A lo largo del adiabat B:
\[q_{rev}=0 \nonumber \]
A lo largo del calentamiento isocórico C, no hay trabajo de volumen porque el volumen se mantiene constante, de manera que:
Este es el único calor reversible involucrado en el camino B+C Sin embargo, sabemos que\(\Delta U_{tot}\) para el camino A es cero (¡isotérmico!). Esto significa que el volumen de trabajo a lo largo de B debe cancelar el calor a lo largo de C:
El mantenimiento de libros se ve de la siguiente manera, todos los caminos son reversibles:
\[\Delta U_{B+C} = \Delta U_A = 0 = q_B + w_B + q_C + w_C \nonumber \]
Sabemos que\(q_B=0\) como es un adiabat y\(w_C=0\) como es una isocora:
\[\Delta U_{B+C} = \Delta U_A = 0 = 0 + w_B + q_C + 0 \nonumber \]
Por lo tanto:
\[w_B=-q_C \nonumber \]
Ya habíamos visto antes eso a lo largo de la isoterma A:
\[w_A = - q_A = - nRT \ln \dfrac{V_1}{V_2} \nonumber \]
Como puedes ver\ W_a\) y no\(w_B\) son lo mismo. El trabajo es una función de ruta, aunque sea reversible. Como estamos trabajando con un gas ideal podemos ser más precisos sobre\(w_B\) y\(q_c\) también. El término\(w_B\) a lo largo del adiabat es trabajo de volumen reversible. Como no hay calor a lo largo de B podemos escribir una recta\(d\) en lugar de\(\delta\) para las contribuciones de trabajo (Es la única contribución y debe ser idéntica a la función de estado\(dU\)):



