20.7: La termodinámica proporciona información sobre la conversión del calor en trabajo
- Page ID
- 80323
El calor y el trabajo son ambas formas de transferir energía, y bajo las circunstancias adecuadas, una forma puede transformarse en la otra. Sin embargo, la segunda ley de la termodinámica pone una limitación a esto. Pasar del trabajo al calor se llama disipación y no hay ninguna limitación en esto en absoluto. De hecho fue a través de la disipación (por fricción) que descubrimos que el calor y el trabajo eran ambas formas de energía. Sin embargo, existe una limitación en la conversión del calor en trabajo.
El Ciclo Carnot
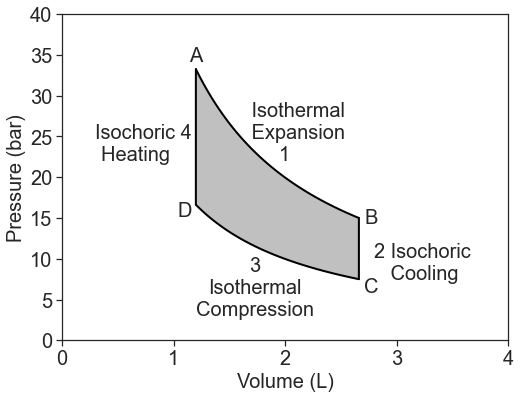
Consideremos una trayectoria circular y reversible de un gas ideal en un diagrama fotovoltaico:
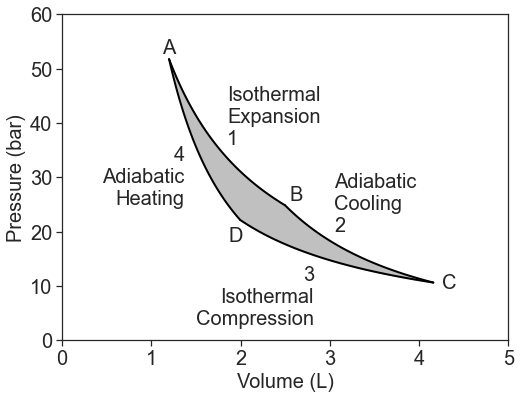
Este ciclo forma el motor térmico de ciclo Carnot de 4 etapas. Un motor térmico convierte la energía térmica en trabajo. El ciclo consta de:
- Expansión isotérmica a la temperatura caliente,\(T_h\):\[\Delta U_1=w_1+q_h=0 \nonumber \]
- Enfriamiento adiabático desde\(T_h\) hasta\(T_c\):\[\Delta U_2=w_2 \nonumber \]
- Compresión isotérmica a la temperatura fría,\(T_c\):\[\Delta U_3=w_3+q_c=0 \nonumber \]
- Calefacción adiabática desde\(T_c\) hasta\(T_h\):\[\Delta U_4=w_4 \nonumber \]
El proceso total de cuatro pasos produce trabajo porque\(w_{hot} > w_{cold}\). El trabajo es la integral debajo de la isoterma superior menos la que está debajo de la curva inferior, es decir, la superficie intermedia.
Sadi Carnot era un ingeniero francés a principios del siglo XIX. Consideró un proceso cíclico que involucra un cilindro lleno de gas. Este ciclo el ciclo Carnot contribuyó en gran medida al desarrollo de la termodinámica y al mejoramiento de la máquina de vapor. Carnot demostró que la temperatura fría a la derecha es tan importante como la fuente de calor de la izquierda para definir la posible eficiencia de un motor térmico
Eficiencia
Por supuesto que gastamos buen dinero en el combustible para iniciar el ciclo calentando las cosas. Entonces, ¿cuánto trabajo conseguimos por el calor que ponemos? Es decir, queremos saber qué tan eficiente es nuestro motor térmico. La eficiencia,\(\eta\) de un motor térmico es:
\[\eta=\frac{|w_\text{cycle}|}{q_h}=\frac{q_h+q_c}{q_h}=1+\frac{q_c}{q_h} \nonumber \]
Para obtener el trabajo del ciclo, podemos hacer uso de la energía interna como una función de estado. Como la ruta es circular las integrales circulares para\(U\) es cero:
\[\oint{dU}=\Delta U_{\text{cycle}}=\sum{\Delta U_i}=w_1+q_h+w_2+w_3+q_c+w_4=0 \nonumber \]
Reorganización:
\[q_h+q_c=-w_1-w_2-w_3-w_4=-w_\text{cycle} \nonumber \]
Un motor ideal tomaría\(q_h\rightarrow q_c\) con una eficiencia del 100%. El trabajo del ciclo será equivalente a la transferencia de calor. Para gases ideales:
- \(w_1=-RT_h\ln{\left(\frac{V_B}{V_A}\right)}=-q_h\)
- \(dU=\delta w=\bar{C}_VdT\rightarrow w_2={\bar{C}}_V\left(T_c-T_h\right)\)
- \(w_3=-RT_c\ln{\left(\frac{V_D}{V_C}\right)}=-q_c\)
- \(w_4={\bar{C}}_V\left(T_h-T_c\right)\)
Encontrar una expresión para\(w_\text{cycle}\):
\[\begin{split} w_\text{cycle} &= -RT_h\ln{\left(\frac{V_B}{V_A}\right)}+{\bar{C}}_V\left(T_c-T_h\right)-RT_c\ln{\left(\frac{V_D}{V_C}\right)}+{\bar{C}}_V\left(T_h-T_c\right) \\ &= -RT_h\ln{\left(\frac{V_B}{V_A}\right)}-RT_c\ln{\left(\frac{V_D}{V_C}\right)}= -R(T_h-T_c)\ln{\left(\frac{V_B}{V_A}\right)} \end{split} \nonumber \]
Tenemos una expresión para el trabajo, así podemos evaluar la eficiencia,\(\eta\). La eficiencia del motor Carnot es:
\[\eta=\frac{|w_\text{cycle}|}{q_h}=\frac{R\left(T_h-T_c\right)\ln{\left(\frac{V_B}{V_A}\right)}}{RT_h\ln{\left(\frac{V_B}{V_A}\right)}}=\frac{T_h-T_c}{T_h}=1-\frac{T_c}{T_h} \nonumber \]
Las rutas (2) y (4) son adiabats, por lo que también podemos usar entropía,\(S\), para obtener la misma solución:
\[\oint{dS}= \frac{q_h}{T_h}+\frac{q_c}{T_c}=0 \nonumber \]
Por lo tanto:
\[ \dfrac{q_c}{q_h} = -\dfrac{T_c}{T_h} \nonumber \]
Y lo conseguimos:
\[η= 1+ \dfrac{q_c}{q_h} = 1-\dfrac{T_c}{T_h} \label{eff} \]
Como ves solo podemos obtener una eficiencia total si\(T_{cold}\) es de 0 K, que nunca lo es (es decir, siempre desperdiciamos energía). Otra implicación es que si\(T_c = T_h\) entonces no se puede obtener ningún trabajo, no importa cuánta energía esté disponible en el de calor. O en otras palabras, si uno disipa el trabajo en calor isotérmicamente, ninguno de ellos puede ser recuperado. La ecuación no\(\ref{eff}\) es muy indulgente en absoluto. Solo imagina que tienes una fuente de calor de, digamos, 400 K (un charco de agua sobrecalentado, por ejemplo, un géiser) y estás arrojando en el río a temperatura ambiente 300 K. La mejor eficiencia que obtendrás es:
\[η= 1-\dfrac{300}{400}= 24\% \nonumber \]
Lamentablemente, estarías arrojando tres cuartas partes de tu energía como calor en el río (y ese es el mejor de los casos, ya que siempre hay más pérdidas, por ejemplo, debido a la fricción). La flecha que dice\(Q_C\) en la Figura 20.7.3 debería entonces ser tres veces más gorda que la que dice\(w\).

Bombas de calor
Por lo que conseguir nuestro trabajo del calor es duro y siempre menos del 100% exitoso. Al revés debería ser fácil. Después de todo, ¡podemos disipar el trabajo en calor libremente incluso en condiciones isotérmicas!
¿Qué pasa si dejamos que el motor térmico funcione hacia atrás? Considera revertir todos los flujos en el diagrama anterior. Obviamente debemos ponernos a trabajar para que el ciclo funcione a la inversa. El calor ahora fluirá de frío a calor, digamos de tu jardín frío a tu lindo y cálido apartamento. La cantidad de calor que obtienes en tu humilde morada será la suma de todo el trabajo (digamos 100 julios) que disipas más el calor que bombeaste fuera del jardín (digamos 300 julios). Así, si estás dispuesto a pagar por la energía que disipas (100 Julios), ¡bien podrías terminar con un total de 400 Julios de calor en tu departamento! Obviamente si es calor después de esto es mejor trato que simplemente disipar el trabajo en su departamento (quemando un poco de aceite). Entonces solo obtendrías 100 J por tu preciado dólar.
Disiparlo como calefacción eléctrica es aún peor porque lo harías
- primera quemadura (¡mucho más!) aceite para generar calor
- usar este calor para producir trabajo eléctrico a un gran costo porque gran parte de las calores se vierten en el lado de baja temperatura (el río o así)
- disipa de nuevo el trabajo en tu departamento (sin usarlo para bombear calor del jardín)
Los refrigeradores también son bombas de calor. Calientan la cocina bombeando calor desde sus entrañas a la cocina. Si mantengo la puerta abierta, sin embargo, todo lo que hace es disipar preciosos trabajos eléctricos, porque el calor bombeado volverá a fluir hacia sus entrañas y echará a perder la leche.
Motor Stirling
Consideremos otro tipo de motor térmico, el motor Stirling. El motor Stirling utiliza una trayectoria circular reversible en un diagrama PV ideal:
El camino consta de cuatro pasos:
- Expansión isotérmica a la temperatura caliente\(T_h\):\[q_1=q_h =-w \nonumber \] y conseguimos trabajo (es decir, trabajo negativo):\[w_h =-RT_h \ln \left( \dfrac{V_B}{V_A} \right) \nonumber \]
- Calentamiento isocórico de\(T_c\) a\(T_h\) (con constante\(C_V\)):\[q_2= \dfrac{C_V}{ΔT} \label{q2} \]
- Compresión isotérmica a la temperatura fría\(T_c\):\[q_3=q_c =-w \nonumber \] y debemos poner trabajo en (es decir, trabajo positivo):\[w_c =-RT_c \ln \left( \dfrac{V_D}{V_C}\right)=RT_c \ln \left( \dfrac{V_B}{V_A} \right) \nonumber \]
- Enfriamiento isocórico de\(T_h\) a\(T_c\) (con constante\(C_V\)):\[q_4= -\dfrac{C_V}{ΔT} \label{q4} \]
Observe que esta área gris se desvanece si\(T_{h}= T_{c}\). ¡Obviamente qué frío es de gran importancia el lado frío! La cantidad de trabajo también es igual a la diferencia en el calor recogido a alta temperatura\(q_h\) y vertido a baja temperatura\(q_{c}\). Los calores isocóricos cancelan. El problema es que solo\(q_{c}\) es cero si la temperatura fría es de 0 K. Eso significa que nunca podremos obtener todo el calor que recogemos a altas temperaturas para salir como trabajo.

