24.4: Las soluciones ideales obedecen a la ley de Raoult
- Page ID
- 79345
Los líquidos tienden a ser volátiles, y como tales entrarán en la fase de vapor cuando la temperatura se incremente a un valor suficientemente alto, siempre que no se descompongan primero. Un líquido volátil es aquel que tiene una presión de vapor apreciable a la temperatura especificada. Una mezcla ideal que contiene al menos un líquido volátil puede describirse usando la Ley de Raoult:
\[P_j = x_jP^*_j \nonumber \]
La ley de Raoult se puede utilizar para predecir la presión de vapor total por encima de una mezcla de dos líquidos volátiles. Resulta que la composición del vapor será diferente a la de los dos líquidos, teniendo el compuesto más volátil una fracción molar mayor en la fase vapor que en la fase líquida. Esto se resume en el siguiente diagrama para una mezcla ideal de dos compuestos, agua y etanol a 75 °C. A esta temperatura, el agua tiene una presión de vapor puro de 384 Torr y el etanol tiene una presión de vapor puro de 945 Torr. En la Figura 24.4.1, la composición de la fase líquida está representada por la línea continua y la composición de la fase vapor está representada por la línea discontinua.
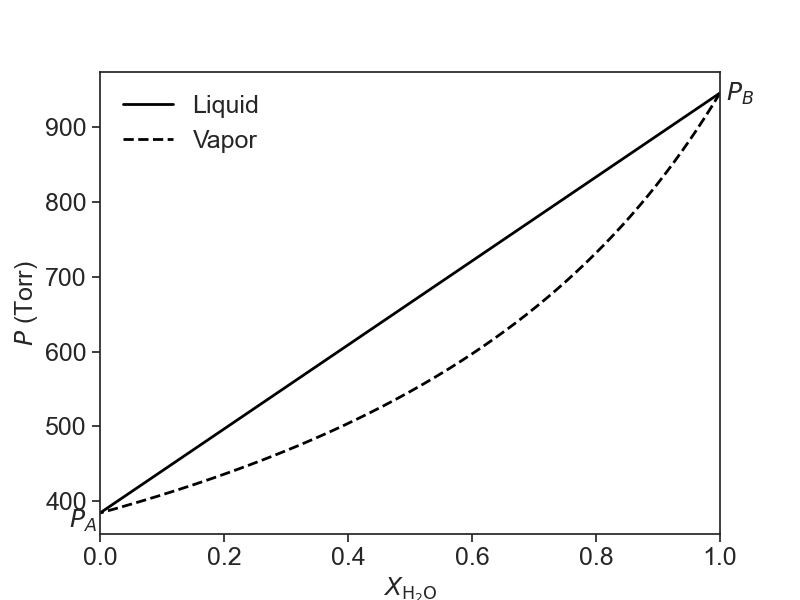
Figura 24.4.1: La composición de la fase líquida (línea continua) y la fase vapor (línea discontinua) en función de la fracción molar según la ley de Raoult. La solución es una mezcla de agua y etanol. \(P_A\)es la presión de vapor del agua pura y\(P_B\) es la presión de vapor del etanol puro a 75 °C
A menudo, es deseable representar el diagrama de fases a una sola presión para que la temperatura y la composición sean las variables incluidas en la representación gráfica. En dicho diagrama, el vapor, que existe a temperaturas más altas) se indica en la parte superior del diagrama, mientras que el líquido está en la parte inferior. Un diagrama típico de temperatura vs. composición se representa en la Figura 24.4.2 para una mezcla ideal de dos líquidos volátiles.
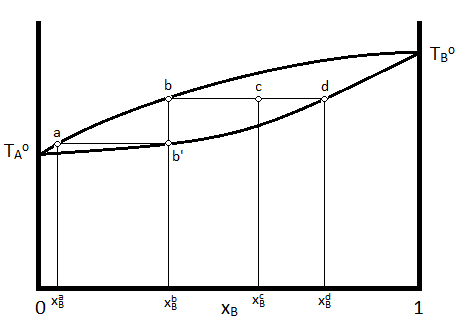
En este diagrama,\(T_A\) y\(T_B\) representan los puntos de ebullición de compuestos puros\(A\) y\(B\). Si un sistema que tiene la composición indicada por\(\chi_B^c\) tiene su temperatura aumentada a la indicada por punto\(c\), El sistema constará de dos fases, una fase líquida, con una composición indicada por\(\chi_B^d\) y una fase vapor indicada con una composición indicada por\(\chi_B^b\). Las cantidades relativas de material en cada fase pueden ser descritas por la regla de la palanca, como se ha descrito anteriormente.
Además, si el vapor con composición\(\chi_B^b\) se condensa (la temperatura se baja a la indicada por el punto b') y se re-vaporiza, el nuevo vapor tendrá la composición consistente con\(\chi_B^a\). Esto demuestra cómo el líquido más volátil (el que tiene la temperatura de ebullición más baja, que es\(A\) en el caso del diagrama anterior) puede purificarse de la mezcla recogiendo y reevaporando fracciones del vapor. Si el líquido fuera el producto deseado, se recogerían fracciones del líquido residual para lograr el resultado deseado. Este proceso se conoce como destilación.
La energía Gibbs de la mezcla es siempre negativa
Cuando agregamos\(n_A\) moles de componente\(A\) y\(n_B\) moles de componente\(B\) para formar una solución líquida ideal, este es generalmente un proceso espontáneo. Consideremos el cambio de energía libre de Gibbs de ese proceso:
\[ \Delta_{mix}G = n_1\mu_1^{sln}+n_2\mu_2^{sln} - (n_1\mu_1^* + n_2\mu_2^*) \]
Usando:
\[ \mu_i^{sln} \equiv \mu_i^* + nRTx_i\ln{x_i} \]
su expresión simplifica a:
\[ \Delta_{mix} G = nRTx_A\ln{x_A} + nRTx_B\ln{x_B} \]
donde\(n\) está el total de moles. La fracción molar,\(x_i\), siempre es menor que uno, por lo que la energía Gibbs de mezclar siempre es negativa; la mezcla siempre es espontánea. Podemos generalizar esto a mezclas con más de dos componentes:
\[ \Delta_{mix} G = nRT\sum_i{x_i\ln{x_i}} \]
Esta expresión parece sospechosamente familiar. Aparte de un factor de\(-T\), es como la entropía de mezclar:
\[ \Delta_{mix} S = -nR\sum_i{x_i\ln{x_i}} \]
Recordando la relación entre la energía de Gibbs y la entropía:
\[ \Delta_{mix} G = \Delta_{mix}H-T\Delta_{mix}S \]
Esto no deja espacio para un efecto de entalpía:
\[ \Delta_{mix} H = 0 \]
A pesar de que hay fuertes interacciones entre partículas vecinas en líquidos, no hay cambio de entalpía. Esto implica que no importa cuáles sean las moléculas vecinas. Si representamos la energía de interacción promedio entre molécula\(i\) y\(j\) por\(U_{ij}\), estamos como sumando que siempre\(U_{ij}\) es lo mismo. En la práctica, esto rara vez es el caso. Por lo general sí importa y entonces el término de entalpía no es cero. Como esto afecta la termodinámica de la solución líquida, también debe afectar las presiones de vapor que están en equilibrio con ella.
En el caso ideal, los volúmenes son aditivos
A partir del cambio de\(G\) en sus variables naturales, sabemos que:
\[ \left (\dfrac{\partial G}{\partial P} \right)_T =V \nonumber \]
Esto quiere decir que si tomamos
\[ \left (\dfrac{\partial \Delta G}{\partial P} \right)_T =\Delta V_{mix} \nonumber \]
En el caso ideal obtenemos:
\[ \left (\dfrac{\partial \Delta G^{ideal}}{\partial P} \right)_T =\Delta V_{mix}^{ideal} \nonumber \]
\[ \left (\dfrac{\partial RT ( n_1 \ln x_1 + n_2\ln x_2)}{\partial P} \right)_T =\Delta V_{mix}^{ideal} =0 \nonumber \]
En el caso ideal, los volúmenes son aditivos y no necesitamos preocuparnos por cómo cambian los volúmenes molares parciales con la composición.

