24.5: La mayoría de las soluciones no son ideales
- Page ID
- 79334
Si trazamos la presión parcial de un componente\(P_1\), por encima de una mezcla con una fracción molar\(x_1\), deberíamos obtener una línea recta con una pendiente de\(P^*_1\) (ley de Raoult). Por encima de las soluciones no ideales la gráfica ya no será una línea recta sino una curva. Sin embargo, hacia\(x_1=1\) la curva típicamente se acerca a la línea de Raoult. En el otro extremo, a menudo también hay una región más o menos lineal, pero con una pendiente diferente (Figura 24.5.1 ). Esto significa que podemos identificar dos leyes limitantes:
- Por\(x \rightarrow 0\): Ley de Henry:
\[P_1 = K_H x_1 \nonumber \]
- Por\(x \rightarrow 1\): Ley de Raoult:
\[P_1 = P^*_1 x_1 \nonumber \]
Esto implica que la línea recta que indica la expresión de Henry cruzará el eje y en\(x=1\) (compuesto puro) en un punto diferente al\(P^*\). Para\(x \rightarrow 0\) (concentraciones bajas) podemos hablar de que el componente 1 es el soluto (el componente minoritario). En el otro extremo\(x \rightarrow 1\) juega el papel del solvente (componente mayoritario).
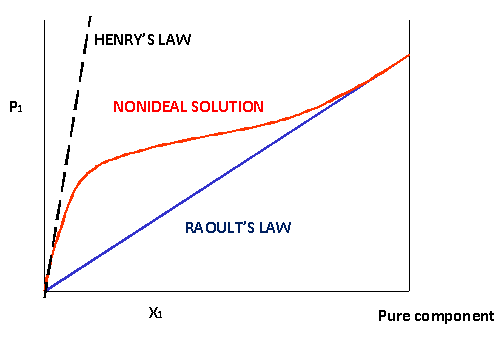
Otra cosa a tener en cuenta\(P^*\) es que es una propiedad de un componente puro, el valor de\(K_H\) por contraste es una propiedad de la combinación de dos componentes, por lo que necesita medirse para cada combinación soluto-disolvente.
Como pueden ver tenemos una descripción tanto para el extremo alto como para el bajo, pero no en el medio. En general, cuanto más modestas son las desviaciones de la idealidad, mayor es el rango de validez de las dos leyes limitantes. La forma de determinar\(K_H\) sería determinar realmente las presiones de vapor. ¿Qué tal el otro componente? ¿Necesitamos medirlos también? Afortunadamente podemos usar la termodinámica para responder a esta pregunta sin. Hay una expresión práctica que nos ahorra la molestia.

