25.2: Las actividades de los solutos no volátiles
- Page ID
- 79787
Para los gases no ideales, introdujimos en el capítulo 11 el concepto de fugacidad como una presión efectiva que da cuenta de un comportamiento no ideal. Si extendemos este concepto a una solución no ideal, podemos introducir la actividad de un líquido o un sólido,\(a\), como:
\[\begin{equation} \mu_{\text{non-ideal}} = \mu^{- {\ominus} } + RT \ln a, \tag{14.1} \label{14.1} \end{equation}\]
donde\(\mu\) está el potencial químico de la sustancia o la mezcla, y\(\mu^{-\ominus}\) es el potencial químico en estado estándar. Comparando esta definición con la Ecuación\ ref {11.29}, es claro que la actividad es igual a la fugacidad para un gas no ideal (que, a su vez, es igual a la presión para un gas ideal). Sin embargo, para una mezcla líquida y líquida, depende del potencial químico en estado estándar. Esto significa que la actividad no es una cantidad absoluta, sino más bien un término relativo que describe qué tan “activo” se compara un compuesto con las condiciones estatales estándar. La elección del estado estándar es, en principio, arbitraria, pero las convenciones a menudo se eligen por conveniencia matemática o experimental. Ya discutimos la convención en la que se encuentra el estado estándar para un gas\(P^{-\ominus}=1\;\text{bar}\), por lo que la actividad es igual a la fugacidad. El estado estándar para un componente en una solución es el componente puro a la temperatura y presión de la solución. Esta definición equivale a establecer la actividad de un componente puro,\(i\), a\(a_i=1\).
Para un componente en una solución podemos usar la Ecuación\ ref {11.29} para escribir el potencial químico en la fase gaseosa como:
\[\begin{equation} \mu_i^{\text{vapor}} = \mu_i^{- {\ominus} } + RT \ln \dfrac{P_i}{P^{-\ominus}}. \tag{14.2} \label{14.2} \end{equation}\]
Si la fase gaseosa está en equilibrio con la solución líquida, entonces:
\[\begin{equation} \mu_i^{\text{solution}} = \mu_i^{\text{vapor}} = \mu_i^*, \tag{14.3} \label{14.3} \end{equation}\]
donde\(\mu_i^*\) está el potencial químico del elemento puro. Restando la Ecuación\ ref {14.3} de la Ecuación\ ref {14.2}, obtenemos:
\[\begin{equation} \mu_i^{\text{solution}} = \mu_i^* + RT \ln \dfrac{P_i}{P^*_i}. \tag{14.4} \label{14.4} \end{equation}\]
Para una solución ideal, podemos usar la ley de Raoult, Ecuación\ ref {13.1}, para reescribir la ecuación\ ref {14.4} como:
\[\begin{equation} \mu_i^{\text{solution}} = \mu_i^* + RT \ln x_i, \tag{14.5} \label{14.5} \end{equation}\]
que relaciona el potencial químico de un componente en una solución ideal con el potencial químico del líquido puro y su fracción molar en la solución. Para una solución no ideal, la presión parcial en la Ecuación\ ref {14.4} es mayor (desviación positiva) o menor (desviación negativa) que la presión calculada usando la ley de Raoult. Luego se calcula el potencial químico de un componente en la mezcla usando:
\[\begin{equation} \mu_i^{\text{solution}} = \mu_i^* + RT \ln \left(\gamma_i x_i\right), \tag{14.6} \label{14.6} \end{equation}\]
donde\(\gamma_i\) es un coeficiente positivo que da cuenta de las desviaciones de la idealidad. Este coeficiente es mayor que uno (para desviaciones positivas), o menor que uno (para desviaciones negativas). La actividad del componente se\(i\) puede calcular como una fracción molar efectiva, utilizando:
\[\begin{equation} a_i = \gamma_i x_i, \tag{14.7} \label{14.7} \end{equation}\]
donde\(\gamma_i\) se define como el coeficiente de actividad. La presión parcial del componente puede relacionarse entonces con su presión de vapor, utilizando:
\[\begin{equation} P_i = a_i P_i^*. \tag{14.8} \label{14.8} \end{equation}\]
Comparando la ecuación\ ref {14.8} con la ley de Raoult, podemos calcular el coeficiente de actividad como:
\[\begin{equation} \gamma_i = \dfrac{P_i}{x_i P_i^*} = \dfrac{P_i}{P_i^{\text{R}}}, \tag{14.9} \label{14.9} \end{equation}\]
donde\(P_i^{\text{R}}\) se calcula la presión parcial usando la ley de Raoult. Este resultado también demuestra que para una solución ideal,\(\gamma=1\). La ecuación\ ref {14.9} también se puede utilizar experimentalmente para obtener el coeficiente de actividad a partir del diagrama de fases de la solución no ideal. Esto se logra midiendo el valor de la presión parcial del vapor de una solución no ideal. Se reportan ejemplos de este procedimiento para desviaciones tanto positivas como negativas en la Figura\(\PageIndex{1}\).
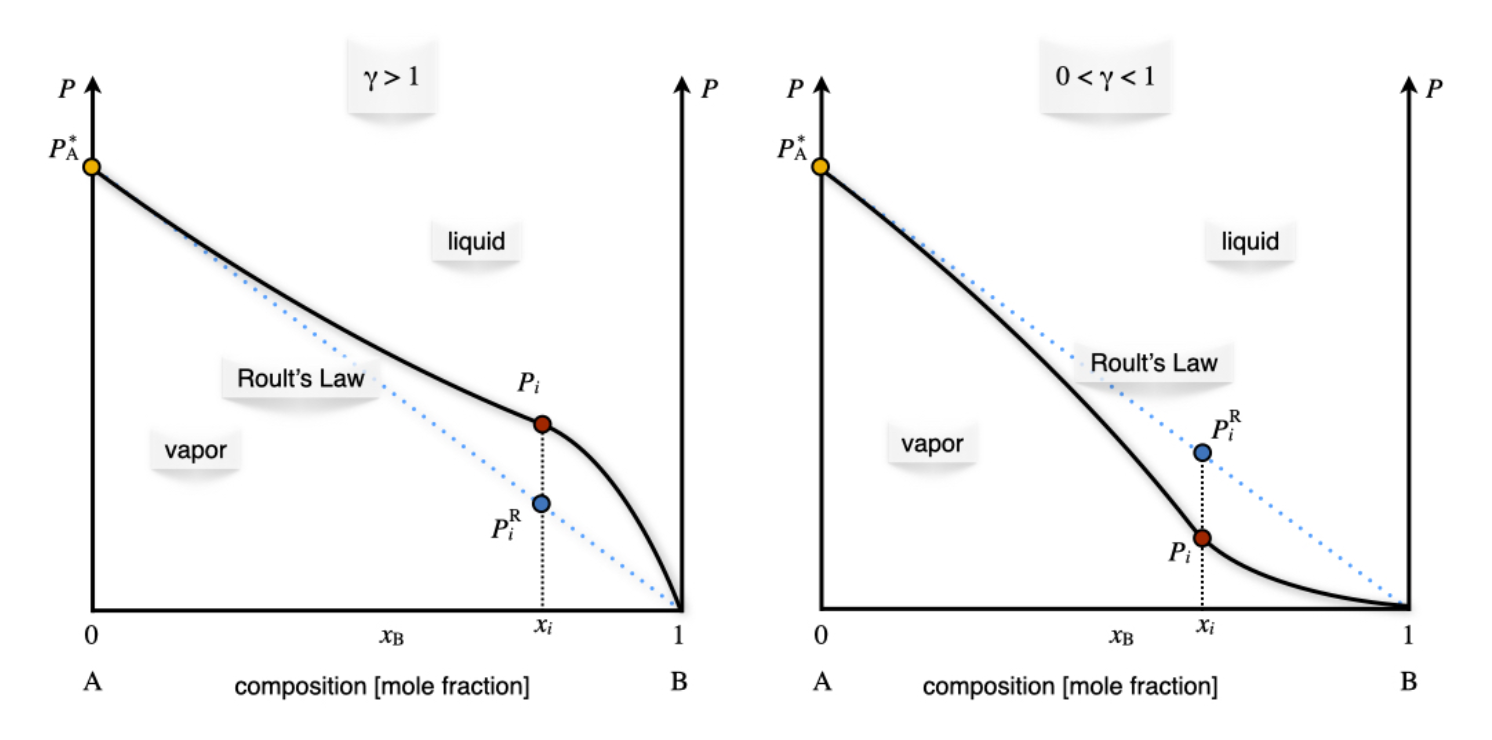
Como ya discutimos en el capítulo 10, la actividad es la cantidad más general que podemos usar para definir la constante de equilibrio de una reacción (o el cociente de reacción). La ventaja de usar la actividad es que se define para gases y mezclas de gases ideales y no ideales, así como para soluciones ideales y no ideales tanto en la fase líquida como en la sólida. \(^1\)
- Obsérvese que, dado que la actividad es una medida relativa, la constante de equilibrio expresada en términos de las actividades es también un concepto relativo. En otras palabras, mide el equilibrio relativo a un estado estándar. Este hecho, sin embargo, no debería sorprendernos, ya que la constante de equilibrio también está relacionada con el\(\Delta_{\text{rxn}} G^{-\ominus}\) uso de la relación de Gibbs. Es por eso que la definición de un estado estándar universalmente convenido es un concepto tan esencial en química, y por qué es definido por la Unión Internacional de Química Pura y Aplicada (IUPAC) y seguido sistemáticamente por químicos de todo el mundo. ︎

