25.7: Extendiendo la teoría de Debye-Hückel a concentraciones más altas
- Page ID
- 79796
La ecuación para\(\log \gamma _{\pm }\) predicha de la ley limitante de Debye—Hückel es:
\[\log _{10}\gamma _{\pm }=-Az_{j}^{2}{\frac {\sqrt {I}}{1+Ba_{0}{\sqrt {I}}}} \label{DH}\]
Da concordancia satisfactoria con mediciones experimentales para concentraciones bajas de electrolitos, típicamente menores de\(10^{−3} mol/L\). Las desviaciones de la teoría ocurren a concentraciones más altas y con electrolitos que producen iones de mayores cargas, particularmente electrolitos asimétricos. Estas desviaciones ocurren debido a que el modelo está sobre-simplificado, por lo que hay poco que ganar haciendo pequeños ajustes al modelo. En cambio, debemos desafiar los supuestos individuales del modelo:
- Los iones no interactúan entre sí. La asociación de iones puede tener lugar, particularmente con iones de mayor carga. Esto fue seguido en detalle por Niels Bjerrum. La longitud de Bjerrum es la separación a la que la interacción electrostática entre dos iones es comparable en magnitud a\(kT\).
- Disociación completa. Un electrolito débil es aquel que no está completamente disociado. Como tal tiene una constante de disociación. La constante de disociación puede ser utilizada para calcular el grado de disociación y por lo tanto, realizar la corrección necesaria para calcular los coeficientes de actividad.
- Los iones son cargas puntuales esféricas que no pueden ser polarizables. Los iones, como todos los demás átomos y moléculas, tienen un tamaño finito. Muchos iones, como el ion nitrato\(\ce{NO3^{−}}\), no son esféricos. Los iones poliatómicos son polarizables.
- La composición del disolvente no importa. El disolvente no es un medio sin estructura sino que está compuesto por moléculas. Las moléculas de agua en solución acuosa son dipolares y polarizables. Tanto los cationes como los aniones tienen una fuerte cubierta de solvatación primaria y una cubierta de solvatación secundaria más débil. Las interacciones ion—disolvente se ignoran en la teoría de Debye—Hückel.
- El radio iónico es insignificante. A concentraciones más altas, el radio iónico se vuelve comparable al radio de la atmósfera iónica.
La mayoría de las extensiones de la teoría de Debie-Hückel son de naturaleza empírica. Por lo general, permiten seguir la ecuación de Debye-Hückel a baja concentración y agregar términos adicionales en cierto poder de la fuerza iónica para ajustarse a las observaciones experimentales. Se han propuesto varios enfoques para extender la validez de la teoría de Debye-Hückel.
Ecuación Extendida de Debye-Hückel
Uno de esos enfoques es la Ecuación Extendida de Debye-Hückel:
\[- \log(\gamma) = \dfrac{A|z_+z_-|\sqrt{I}}{1 + Ba\sqrt{I}}\]
donde\(\gamma\) es el coeficiente de actividad,\(z\) es la carga entera del ion\(\mu\) es la fuerza iónica de la solución acuosa, y\(a\), es el tamaño o diámetro efectivo del ion en angstrom. El radio hidratado efectivo del ion,\(a\) es el radio del ion y sus moléculas de agua estrechamente unidas. Los iones grandes y los iones menos cargados unen el agua con menos fuerza y tienen radios hidratados más pequeños que los iones más pequeños y con mayor carga. Los valores típicos son 3 Å para iones tales como H+, Cl-, CN- y HCOO-. El diámetro efectivo para el ion hidronio es de 9 Å.\ (A\) y\(B\) son constantes con valores de 0.5085 y 0.3281 respectivamente a 25°C en agua.
Otros enfoques incluyen la ecuación de Davies, ecuaciones de Pitzer y teoría de interacción iónica específica.
Ecuación de Davis
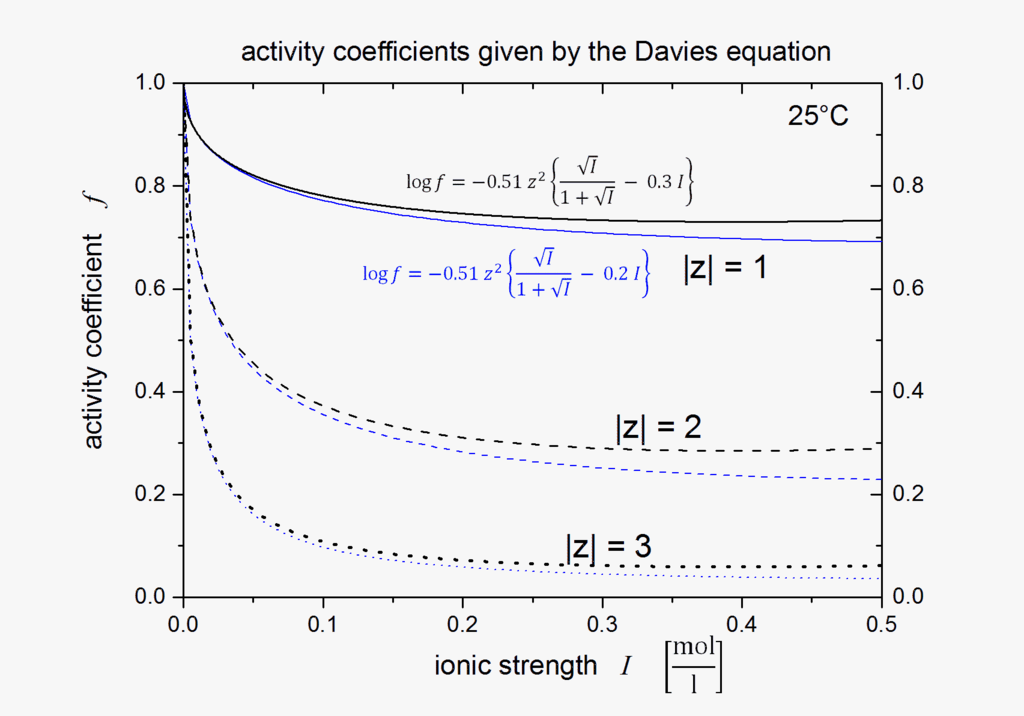
La ecuación de Davies es una extensión empírica de la teoría de Debye-Hückel que se puede utilizar para calcular los coeficientes de actividad de soluciones electrolíticas a concentraciones relativamente altas a 25 °C; la ecuación, publicada originalmente en 1938, se refinó ajustándose a datos experimentales. La forma final de la ecuación da el coeficiente medio de actividad molal f± de un electrolito que se disocia en iones que tienen cargas z1 y z2 en función de la fuerza iónica I:
\[ -\log f_{\pm }=0.5z_{1}z_{2}\left({\frac {\sqrt {I}}{1+{\sqrt {I}}}}-0.30I\right).\]
El segundo término, 0.30\(I\), va a cero ya que la fuerza iónica va a cero, por lo que la ecuación se reduce a la ecuación de Debie-Hückel a baja concentración. Sin embargo, a medida que aumenta la concentración, el segundo término adquiere cada vez más importancia, por lo que la ecuación de Davies puede ser utilizada para soluciones demasiado concentradas para permitir el uso de la ecuación de Debie-Hückel. Para electrolitos 1:1 la diferencia entre los valores medidos y los calculados con esta ecuación es de aproximadamente 2% del valor para soluciones 0.1 M. Los cálculos se vuelven menos precisos para electrolitos que se disocian en iones con cargas más altas. Otras discrepancias surgirán si existe asociación entre los iones, con la formación de pares de iones, tales como\(\ce{Mg^{2+}SO^{2-}4}\).
Gráfica de coeficientes de actividad calculados mediante la ecuación de Davies.
Ecuaciones Pitzer
Las ecuaciones de Pitzer son importantes para la comprensión del comportamiento de los iones disueltos en aguas naturales como ríos, lagos y aguas de mar. Fueron descritos por primera vez por el químico físico Kenneth Pitzer. Los parámetros de las ecuaciones de Pitzer son combinaciones lineales de parámetros, de una expansión virial del exceso de energía libre de Gibbs, que caracterizan las interacciones entre iones y disolvente. La derivación es termodinámicamente rigurosa a un determinado nivel de expansión. Los parámetros pueden derivarse de diversos datos experimentales como el coeficiente osmótico, los coeficientes de actividad iónica mixta y la solubilidad de la sal. Se pueden utilizar para calcular coeficientes de actividad iónica mixta y actividades acuáticas en soluciones de alta fuerza iónica para las que la teoría de Debye-Hückel ya no es adecuada.
Se obtiene una expresión para el coeficiente de actividad medio.
\[\ln \gamma _{\pm }= \dfrac {p\ln \gamma _{M}+q\ln \gamma _{X}}{p+q}\]
\[\ln \gamma _{\pm }=|z^{+}z^{-}|f^{\gamma }+m\left({\frac {2pq}{p+q}}\right)B_{MX}^{\gamma }+m^{2}\left[2{\frac {(pq)^{3/2}}{p+q}}\right]C_{MX}^{\gamma }\]
Estas ecuaciones se aplicaron a un amplio rango de datos experimentales a 25 °C con excelente acuerdo a aproximadamente 6 mol kg−1 para varios tipos de electrólitos. El tratamiento puede extenderse a electrolitos mixtos e incluir equilibrios de asociación. Se han tabulado los valores para los parámetros β (0), β (1) y C para ácidos, bases y sales inorgánicos y orgánicos. También se discute la variación de temperatura y presión.
Teoría de interacción iónica específica
La teoría de interacción iónica específica (teoría SIT) es una teoría utilizada para estimar los coeficientes de actividad de iones individuales en soluciones electrolíticas a concentraciones relativamente altas. Lo hace tomando en consideración los coeficientes de interacción entre los diversos iones presentes en solución. Los coeficientes de interacción se determinan a partir de valores constantes de equilibrio obtenidos con soluciones a diversas fuerzas iónicas. La determinación de los coeficientes de interacción SIT también produce el valor de la constante de equilibrio a dilución infinita.
El coeficiente de actividad del ion jth en solución se escribe como\(γ_j\) cuando las concentraciones están en la escala de concentración molal y como yj cuando las concentraciones están en la escala de concentración molar. (La escala de molalidad es preferida en la termodinámica porque las concentraciones molales son independientes de la temperatura). La idea básica de la teoría SIT es que el coeficiente de actividad puede expresarse como
\[\log \gamma _{j}=-z_{j}^{2}{\frac {0.51{\sqrt {I}}}{1+1.5{\sqrt {I}}}}+\sum _{k}\epsilon _{jk}m_{k}\]
donde z es la carga eléctrica en el ion,\(I\) es la fuerza iónica,\(ε\) y\(b\) son coeficientes de interacción y\(m\) son concentraciones. La suma se extiende sobre los otros iones presentes en solución, que incluye los iones producidos por el electrolito de fondo. El primer término en estas expresiones proviene de la teoría de Debye-Hückel. El segundo término muestra cómo las contribuciones de la “interacción” dependen de la concentración. Así, los coeficientes de interacción se utilizan como correcciones a la teoría de Debye-Hückel cuando las concentraciones son superiores a la región de validez de esa teoría.


