25.6: La teoría de Debye-Hückel
- Page ID
- 79782
Como las soluciones iónicas son muy comunes en química, tener que medir todos los coeficientes de actividad (\(γ_{\pm}\)) para todas las combinaciones posibles de soluto-disolvente es una tarea bastante desalentadora, aunque en tiempos pasados se ha producido una tabulación extensa. Deberíamos estar agradecidos por el rico legado que nos han dejado nuestros predecesores en este sentido. (Sería difícil conseguir algún financiamiento para hacer un trabajo tan tedioso hoy). Por supuesto que sería muy deseable poder calcular\(γ_{\pm}\) valores a partir de primeros principios o si eso falla por medios semiempíricos. Afortunadamente también se han logrado avances considerables en este frente. Solo podemos rayar la superficie de ese tema en este curso y discutiremos brevemente el enfoque más simple debido a Debye y Hückel
Debye y Hückel idearon una expresión teórica que permite predecir los coeficientes medios de actividad iónica como concentraciones suficientemente diluidas. La teoría considera la vecindad de cada ion como una nube de cargas de signo opuesto similar a la atmósfera que cancela la carga del ion central (Figura\(\PageIndex{1}\)). Desde la distancia la nube se ve neutra. La cantidad\(1/κ\) es una medida para el tamaño de esta nube y\(\kappa\) es la longitud del debye-length. Su tamaño depende de la concentración de todos los demás iones.
Fuerza iónica
Para tener en cuenta el efecto de todos los demás iones es útil definir la fuerza iónica (\(I\)) como:
\[I =\dfrac{1}{2} \sum m_iz_i^2 \nonumber \]
donde\(m_i\) está la molalidad del ion\(i\) y\(z_i\) su coeficiente de carga. Tenga en cuenta que los iones altamente cargados (e.g.\(z=3+\)) contribuyen fuertemente (nueve veces más que +1 iones), pero la fórmula es lineal en la molalidad.
Usando la fuerza iónica, la longitud del debye-length se convierte en:
\[κ^2 = constant \, I \nonumber \]
La constante contiene\(kT\) y\(ε_rε_o\) en el denominador y el número de Avogadro\(N_A\) y el cuadrado de la carga del electrón\(e\) en el numerador:
\[constant= 2000 \dfrac{e^2N_A}{ε_rε_okT} \nonumber \]
La longitud de Debye y el coeficiente de actividad iónica media logarítmica son proporcionales:
\[\ln γ_{\pm} \propto κ \nonumber \]
Nuevamente hay una serie de factores en la constante de proporcionalidad:
\[\ln γ_± = -|q_+q_-| \dfrac{κ}{8πε_rε_okT} \nonumber \]
Los factores\(ε_r\) y\(ε_o\) son la permitividad relativa del medio y la permitividad del vacío, respectivamente. Tenga en cuenta que el factor\(8πε_rε_o\) es específico del sistema SI de unidades. En unidades cgs la expresión se vería diferente, porque las permitividades se definen de manera diferente en ese sistema
Si solo hay una sal disuelta la fuerza iónica depende linealmente de su concentración, la longitud de Debye κ y\(\ln γ_±\) por lo tanto van como la raíz cuadrada de concentración (generalmente molalidad):
\[\ln \gamma_{\pm} \propto \sqrt{m} \nonumber \]
Si hay otros iones presentes la fuerza iónica involucra a todos ellos. Este hecho se usa a veces para mantener constante la fuerza iónica mientras se cambia la concentración de un ion en particular. Digamos que deseamos bajar la concentración de Cu 2 + en una reacción redox pero queremos mantener los coeficientes de actividad iguales tanto como sea posible. Entonces podríamos reemplazarlo por un ion de la misma carga digamos Zn 2 + que no participa en la reacción. Una buena manera de hacerlo es diluir la solución de cobre con una solución de zinc de la misma concentración en lugar de con solo disolvente.
El coeficiente de actividad medio viene dado por el logaritmo de esta cantidad de la siguiente manera
\[\log _{10}\gamma _{\pm }=-Az_{j}^{2}{\frac {\sqrt {I}}{1+Ba_{0}{\sqrt {I}}}} \label{DH}\]
con
\[ A={\frac {e^{2}B}{2.303\times 8\pi \epsilon _{0}\epsilon _{r}k_{\rm {B}}T}}\]
\[B=\left({\frac {2e^{2}N}{\epsilon _{0}\epsilon _{r}k_{\rm {B}}T}}\right)^{1/2}\]
donde\(I\) es la fuerza iónica y a0 es un parámetro que representa la distancia de aproximación más cercana de iones. Para soluciones acuosas a 25 °C\(A = 0.51\, mol^{−1}/2dm^{3/2}\) y\(B = 3.29 nm^{−1}mol^{−1}/2dm^{3/2}\).
Desafortunadamente esta teoría solo funciona en concentraciones muy bajas y por lo tanto también se conoce como la ley limitante de Debye (Figura\(\PageIndex{2}\)). Hay una serie de refinamientos que tienen como objetivo ampliar el rango de validez de la teoría para poder trabajar en concentraciones algo mayores.
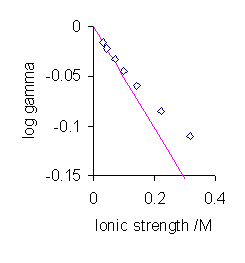
El aspecto más significativo de la Ecuación\ ref {DH} es la predicción de que el coeficiente de actividad promedio es una función de la fuerza iónica en lugar de la concentración de electrolitos. Para valores muy bajos de la fuerza iónica el valor del denominador en la expresión anterior se vuelve casi igual a uno. En esta situación el coeficiente de actividad medio es proporcional a la raíz cuadrada de la fuerza iónica.
Cuando se forma un sólido por una reacción a partir de solución a veces es posible que permanezca disperso como partículas muy pequeñas en el disolvente. Los tamaños suelen oscilar en los nanómetros Es por ello que se ha puesto de moda llamarlas nanopartículas, aunque desde mediados del siglo XIX se las conocía como partículas coloidales. Son menores que la longitud de onda de la razón visible. Esto hace que los líquidos que los contienen permanezcan claros, aunque a veces pueden ser de color hermoso. Un buen ejemplo es la reducción de AUCl 4 - con citrato a oro metálico. Esto produce soluciones claras de vino tinto, incluso a concentraciones diminutas de oro.
\[\ce{2n AuCl4(aq)^{-} + n \,citrate^{3-}(aq) + 2n\, H_2O(l) \rightarrow} \\[4pt] \ce{2n\, Au(colloid) + 3n\, CH2O(aq) + 3n\, CO2(g) + 8n \,Cl^{-}(aq) + 3n\, H^{+}(aq)} \nonumber \]
La razón por la que el oro no precipita completamente es típicamente que las nanopartículas (AuNP) formadas durante la reacción se cargan por la unión de algunas de las especies iónicas en solución a su superficie. Esto da como resultado una partícula cargada con una atmósfera con cierta longitud de Debye alrededor de ella (Figura\(\PageIndex{3}\)). Esta nube cargada evita que la forma de partículas se coalescen con otras partículas por repulsión electrostática.
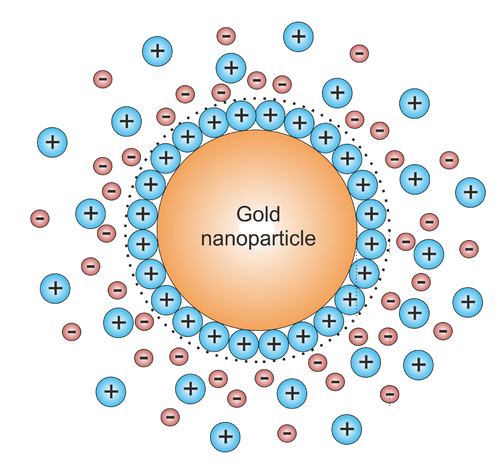
Tal sistema se llama coloide. Por supuesto que estos sistemas son metaestables. A menudo tienen un umbral bastante pequeño para estrellarse a un precipitado real bajo la influencia de las fuertes interacciones de van der Waals que experimentan las partículas una vez que logran entrar en contacto cercano. En las condiciones adecuadas, los coloides pueden sobrevivir por mucho tiempo. Algunos coloides de oro preparados por Faraday en la década de 1850 siguen siendo estables hoy en día.
De lo anterior quedará claro que la adición de una sal -particularmente conteniendo iones altamente cargados como 3+ o 3- puede desestabilizar el coloide debido a que la fuerza iónica cambiará drásticamente y esto afectará la longitud de Debye.

